Hoofdstuk 4
Atomen en Moleculen
§1 Het periodiek systeem §2 Metalen §3 Moleculaire stoffen
§1 Het periodiek systeem
In dit hoofdstuk gaan we kijken naar de verschillende stoffen waar de wereld uit bestaat. Het blijkt dat de wereld bestaat uit 118 verschillende atomen. Deze atomen kunnen o.a. gecombineerd worden tot metaalroosters en moleculen. In deze paragraaf beginnen we met het bestuderen van atomen.
De wereld bestaat uit miljoenen soorten stoffen, maar al deze stoffen blijken te bestaan uit een combinatie van slechts 118 soorten kleine bolvormige deeltjes die we atomen noemen. Elk van de 118 atoomsoorten heeft een naam en een symbool. Dit symbool bestaat uit een hoofdletter en in sommige gevallen ook een kleine letter (zie de onderstaande afbeelding). Een stof die uit slechts één soort atomen bestaat noemen we een element.
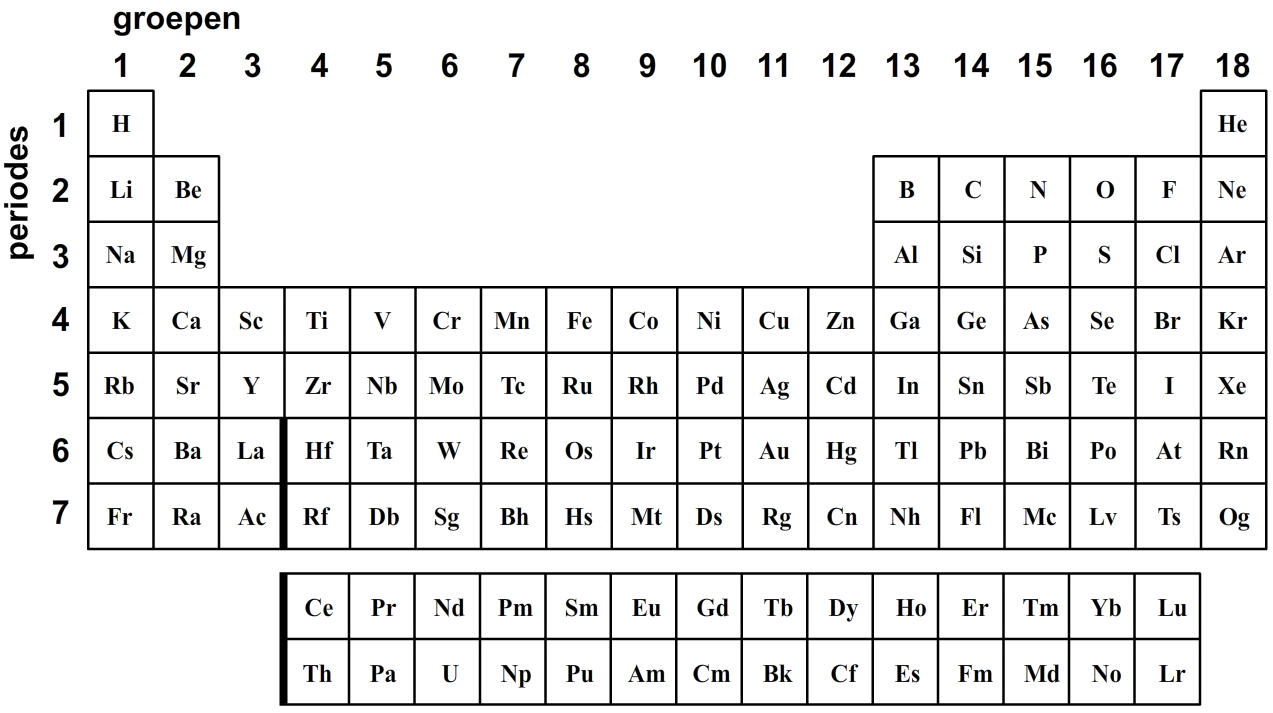
In de 19de eeuw zijn door de wetenschapper Dmitri Mendelejev de atoomsoorten op rij gezet van de lichtste tot de zwaarste. Hij ontdekte toen dat de eigenschappen van de stoffen zich in een vast patroon herhaalden. Bijvoorbeeld, atoom nummer 2 is niet reactief, atoom nummer 3 juist wel en 4 iets minder. Dit herhaalde zich bij atoom 10 (niet reactief), atoom 11 (reactief) en atoom 12 (iets minder reactief). Mendelejev kwam toen op het briljante idee om de stoffen met gelijke eigenschappen onder elkaar te noteren. Het resultaat is de bovenstaande tabel, genaamd het periodiek systeem der elementen.
We lezen dit systeem van links naar rechts en dan rij voor rij naar beneden. De (horizontale) rijen worden ook we periodes genoemd en de (verticale) kolommen worden groepen genoemd. Deze groepen en kolommen zijn hierboven genummerd. Je kan een soortgelijke tabel in BINAS vinden.
De atomen kunnen in drie groepen worden verdeeld. De atoomsoorten die hieronder in grijs zijn weergegeven noemen we metalen. De atoomsoorten die blauw zijn weergegeven noemen we niet-metalen. De atomen in de witte vlakjes worden metalloïden genoemd en zitten qua eigenschappen tussen metalen en niet-metalen in.
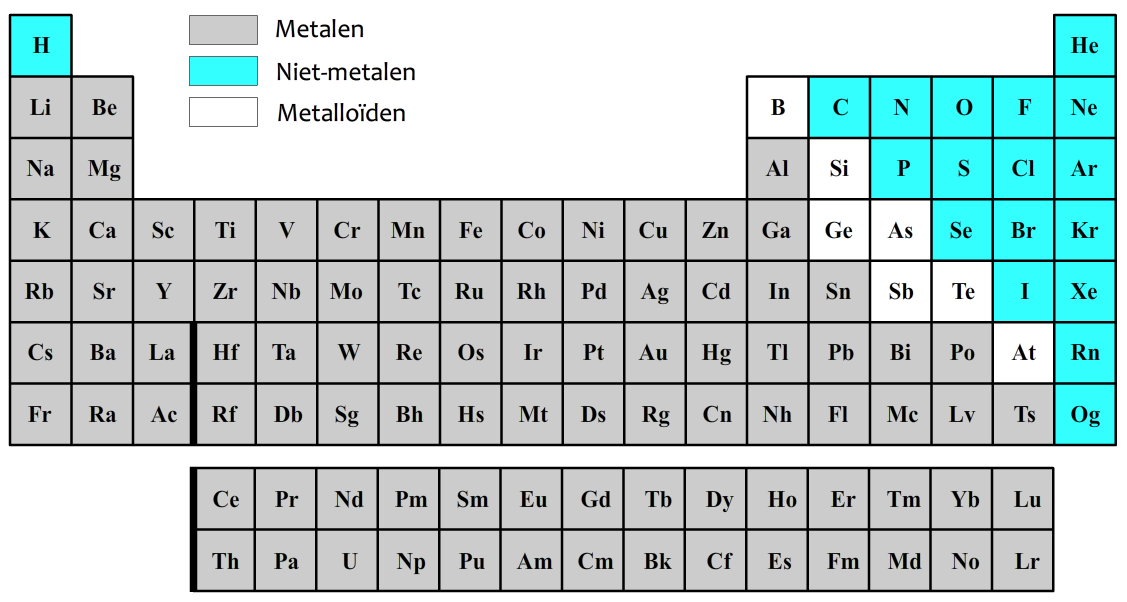
De volgende atoomsoorten en de bijbehorende symbolen moet je uit je hoofd kennen:
| Metaalatomen | Niet-metaalatomen | ||
| Natrium | Na | Waterstof | H |
| Kalium | K | Koolstof | C |
| Magnesium | Mg | Stikstof | N |
| Calcium | Ca | Fosfor | P |
| Barium | Ba | Zuurstof | O |
| Chroom | Cr | Zwavel | S |
| IJzer | Fe | Fluor | F |
| Nikkel | Ni | Chloor | Cl |
| Platinum | Pt | Broom | Br |
| Koper | Cu | Jood | I |
| Zilver | Ag | Helium | He |
| Goud | Au | Neon | Ne |
| Zink | Zn | Argon | Ar |
| Cadmium | Cd | ||
| Kwik | Hg | ||
| Aluminium | Al | ||
| Tin | Sn | Metalloïde | |
| Lood | Pb | Silicium | Si |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Metalen
In deze paragraaf bestuderen we een aantal eigenschappen van metalen.
Metalen zijn te herkennen aan de volgende stofeigenschappen:
- Ze glimmen als ze gepolijst zijn
- Ze zijn buigbaar
- Ze zijn goede geleiders van warmte en elektriciteit
- Ze zijn vast bij kamertemperatuur, met uitzondering van kwik. Dit is vloeibaar bij kamertemperatuur (zie de linker onderstaande afbeelding)
- De meeste metalen zijn grijs, maar ook hier zijn een paar uitzonderingen. Goud is bijvoorbeeld geel en koper is oranje (zie de rechter afbeelding).
 (Afbeelding: images-of-elements.com; CC BY-SA 3.0; Marmall4; CC BY 3.0)
(Afbeelding: images-of-elements.com; CC BY-SA 3.0; Marmall4; CC BY 3.0)
Je kunt kwik tegenwoordig niet meer kopen, omdat het erg giftig is. We moeten het daarom dus even doen met het volgende filmpje:
 EXPERIMENT
EXPERIMENT
|
| In deze filmpjes zien we het vloeibare metaal kwik. |
In de onderstaande afbeelding zijn de metalen in het periodiek systeem in het grijs aangegeven.
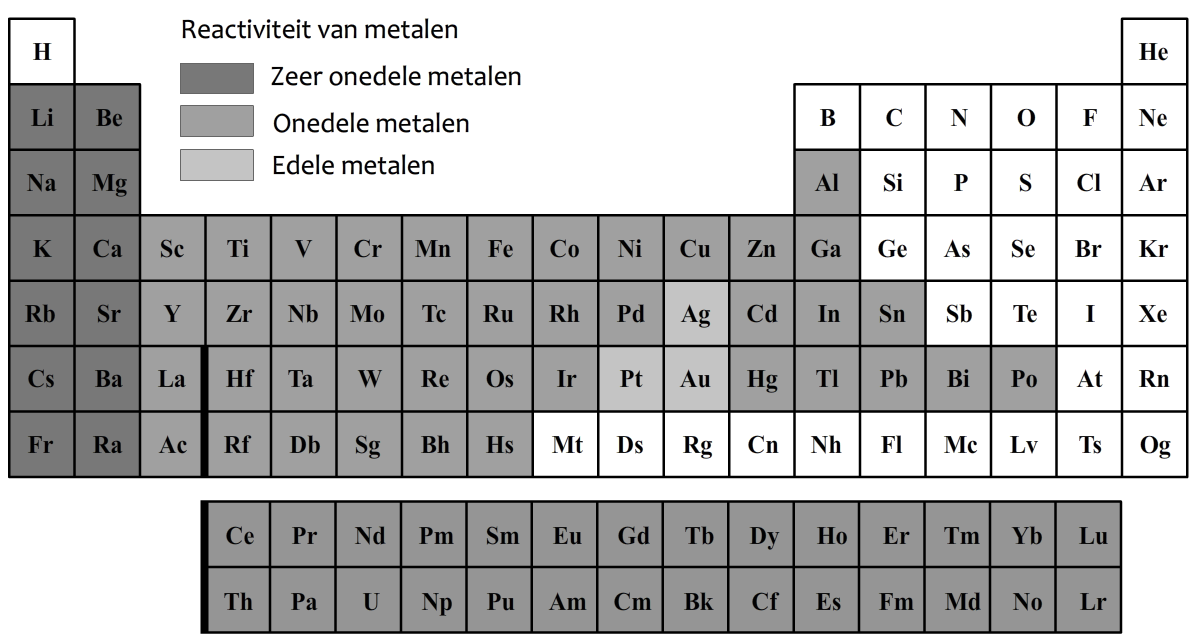
De metalen in de eerste linker twee kolommen van het periodiek systeem worden de zeer onedele metalen genoemd. Deze metalen zijn extreem reactief. De stoffen in de eerste kolom reageren bijvoorbeeld heftig met water en zuurstof. Een voorbeeld is het metaal natrium. In de linker onderstaande afbeelding zien we een explosie die ontstaat als je natrium in water gooit.
De metalen in de tweede kolom reageren iets minder heftig. Deze metalen reageren heftig met zuurstof als ze eerst worden verhit. Rechtsonder zien we bijvoorbeeld een foto van de verbranding van magnesium. Deze chemische reactie zorgt voor een fel wit licht.


 EXPERIMENT
EXPERIMENT
|
| In deze filmpjes zie je de heftige reactie tussen natrium en water. |
 EXPERIMENT
EXPERIMENT
| ||
|
De stoffen zilver (Ag), goud (Au) en platina (Pt) worden edele metalen genoemd. Deze metalen reageren niet of nauwelijks met andere stoffen.
 (Afbeelding: Alchemist-hp; CC BY-SA 3.0 / Alchemist-hp; CC BY-SA 3.0 / Robert Lavinsky; CC BY 3.0)
(Afbeelding: Alchemist-hp; CC BY-SA 3.0 / Alchemist-hp; CC BY-SA 3.0 / Robert Lavinsky; CC BY 3.0)
De overige metalen noemen we de onedele metalen. Deze metalen reageren ook met zuurstof, maar deze reacties verlopen erg langzaam. We noemen de reactie tussen metalen en zuurstof ook wel oxidatie of corrosie. Alleen bij het oxideren van ijzer spreken we ook wel van roesten. Dankzij oxidatie komen we zowel zeer onedele als onedele metalen zo goed als nooit in elementaire vorm tegen in de natuur. Na verloop van tijd zijn al deze metalen immers allemaal geoxideerd.
Een nadeel van de corrosie van ijzer is dat roest erg broos is en zuurstof daardoor gemakkelijk bij het ijzer komt onder de roestlaag, waardoor het verder blijft roesten (zie de linker onderstaande afbeelding). Er zijn ook metalen die meer corrosiebestendig zijn. Dit komt doordat ze een dun en hard oxidelaagje vormen dat het metaal eronder beschermd tegen verdere corrosie. Bij het oxideren van koper ontstaat koperoxide, ook wel patina genoemd. Patina is lichtgroen. Het Vrijheidsbeeld is hier bijvoorbeeld van gemaakt (zie de middelste afbeelding). Bij chroom ontstaat een dun doorzichtig laagje chroomoxide. Doordat dit laagje doorzichtig is, blijft het glimmende metaal eronder goed zichtbaar. Dit is de reden dat bijvoorbeeld ijzeren kranen vaak met een laagje chroom worden bedekt (zie de rechter afbeelding). Dit wordt verchromen genoemd. Een andere manier om ijzer te beschermen tegen corrosie is door het te bedekken met een laagje zink. Dit wordt galvaniseren genoemd. Je kan het ijzer natuurlijk ook gewoon verven.


 (Afbeelding: Dudva; CC BY-SA 4.0 / Matthew Bowden; www.digitallyrefreshing.com; PD )
(Afbeelding: Dudva; CC BY-SA 4.0 / Matthew Bowden; www.digitallyrefreshing.com; PD )
Als we metaalatomen samenbrengen in vaste vorm, dan ordenen ze zich meestal in een regelmatig patroon dat een metaalrooster wordt genoemd (zie de onderstaande afbeelding).

Een zuiver metaal bestaat slechts uit één atoomsoort en als gevolg passen de atomen netjes naast elkaar in het metaalrooster. Het gevolg hiervan is dat de atomen in deze roosters gemakkelijk langs elkaar kunnen worden geschoven (zie de linker onderstaande afbeelding). Zuivere metalen zijn hierdoor buigbaar. Een mengsel van een metaal en een andere stof noemen we een legering. Doordat verschillende soorten atomen verschillende groottes hebben, verbreekt de legering de perfecte ordening van het rooster (zie de middelste twee afbeeldingen). Als gevolg hiervan zijn legeringen een stuk sterker. Een bekend voorbeeld van een legering is staal. Dit bestaat uit ijzer gemengd met een beetje koolstof. Staal wordt bijvoorbeeld gebruikt voor de kabels die een brug omhoog houden (zie de rechter afbeelding).


 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Moleculaire stoffen
In deze paragraaf bestuderen we een aantal eigenschappen van niet-metalen. Ook gaan we leren dat niet-metalen combineren tot moleculen.
Als we niet-metaalatomen samenbrengen, dan groeperen ze zich meestal in vaste combinaties die we moleculen noemen. In de middelste onderstaande afbeelding zien we bijvoorbeeld twee watermoleculen. Moleculen beschrijven we met behulp van een molecuulformule. De molecuulformule van een watermolecuul is H2O, omdat het uit twee waterstofatomen (H2) en één zuurstofatoom (O) bestaat. De "2" in H2O noemen we een index (meervoud indices).

Het soort molecuul bepaalt met welk soort stof we te maken hebben. Neem bijvoorbeeld de onderste twee moleculen. Links zien we water (H2O) en rechts zien we waterstofperoxide (H2O2). Waterstofperoxide bevat slechts één zuurstofatoom meer dan water, maar toch is het een geheel andere stof. Waterstofperoxide wordt bijvoorbeeld gebruikt voor het blonderen van haar!
 Bron: S. Nova (glas water)
Bron: S. Nova (glas water)
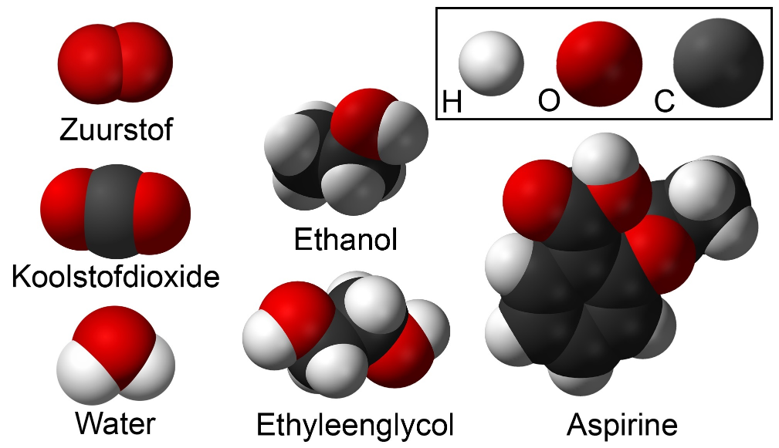
Hieronder zien we een aantal moleculen die we kunnen maken met alleen de atomen waterstof (H), zuurstof (O) en koolstof (C):
Ook de fase van een stof kunnen we weergeven met een molecuulformule. We gebruiken hiervoor de eerste letter van de Engelse woorden "solid" (vaste stof), "liquid" (vloeistof) en "gas" (gas). We schrijven deze letter tussen haakjes achter de molecuulformule (zie de onderstaande afbeelding). We noemen dit ook wel toestandsaanduidingen.

Ook het aantal moleculen kunnen we in de molecuulformule weergeven. Dit doen we door een getal voor de molecuulformule te schrijven. We noemen dit getal de coëfficiënt. In de onderstaande afbeelding zijn bijvoorbeeld 10 watermoleculen in gasfase afgebeeld. Onder de afbeelding zien we de bijbehorende molecuulformule.

 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
| BINAS: | |
| 99 | Periodiek systeem |

