Hoofdstuk 5
Zouten
§1 De bouw van atomen §2 Ionen §3 Zouten §4 Oplossen van zouten
§1 De bouw van atomen
In het vorige hoofdstuk hebben we gezien dat we atomen kunnen combineren in metaalroosters en moleculen. Er is nog een derde optie. We kunnen atomen ook combineren tot zouten. Dit gaan we leren in dit hoofdstuk. Om zouten te begrijpen, moeten we eerst de structuur van het atoom bestuderen. Dat gaan we in deze paragraaf doen.
In het vorige hoofdstuk hebben we geleerd dat materie is opgebouwd uit atomen. Atomen blijken ook weer opgebouwd uit kleinere deeltjes. Elk atoom heeft in zijn centrum een atoomkern, bestaande uit positief geladen deeltjes die we protonen noemen en neutrale deeltjes die we neutronen noemen. Om de kern heen bevindt zich een wolk van negatieve geladen deeltjes die we elektronen noemen. Elk atoom bevat evenveel protonen als elektronen en als gevolg zijn atomen neutraal.

Zoals je in de bovenstaande afbeelding kunt zien, bewegen de elektronen niet willekeurig om de atoomkern. De elektronen bevinden zich op vaste afstanden van de kern. Deze vaste afstanden noemen we schillen. In de binnenste schil passen slechts twee elektronen, in de tweede schil passen 8 elektronen en in de derde schil passen wel 18 elektronen. Het zwaarste atoom dat we kennen heeft wel zeven schillen met daarin 118 elektronen.
Hieronder zien we de eerste 8 atomen uit het periodiek systeem. Waterstof bestaat uit één proton en dus ook één elektron. Helium bestaat uit twee protonen en dus ook twee elektronen. Lithium bevat drie protonen en dus ook drie elektronen, maar omdat de eerste schil vol is, komt het derde elektron in de tweede schil terecht. Op deze manier zijn alle atomen uit het periodiek systeem opgebouwd.

Het aantal protonen in een atoom noemen we het atoomnummer. In het onderstaande periodiek systeem vind je het atoomnummer linksonder de symbolen. Het is belangrijk te onthouden dat voor elke atoomsoort het atoomnummer vast staat. IJzer heeft bijvoorbeeld altijd atoomnummer 26 (ga dit zelf even na met behulp van de onderstaande afbeelding).

Het aantal protonen en neutronen samen noemen we het massagetal. In het bovenstaande periodiek systeem kunnen we het massagetal linksboven de symbolen vinden. Fluor heeft bijvoorbeeld atoomnummer 9 en massagetal 19. Een atoomnummer van 9 vertelt ons dat fluor 9 protonen in de kern heeft. Een massagetal van 19 vertelt ons dat het aantal neutronen en protonen samen 19 is. Hieruit kunnen we concluderen dat fluor 19 - 9 = 10 neutronen in de kern heeft. Waterstof heeft een atoomnummer van 1 en bevat dus slechts 1 proton. Het massagetal van waterstof is ook 1, dus waterstof bevat 0 neutronen.
Het massagetal van atomen staat niet vast. De waarden die hierboven in de tabel staan zijn slechts gemiddelde waarden.
 Zorg dat je het aantal protonen, neutronen en elektronen in een atoom kan identificeren met behulp van het atoomnummer en het massagetal
Zorg dat je het aantal protonen, neutronen en elektronen in een atoom kan identificeren met behulp van het atoomnummer en het massagetal
|
|
§2 Ionen
Tijdens chemische reacties kunnen atomen elektronen opnemen of afstaan. Hierbij ontstaan ionen. In deze paragraaf gaan we dit proces bestuderen. In de volgende paragraaf zullen we zien dat ionen de bouwstenen zijn van zouten.
Tijdens chemische reacties is het mogelijk dat de buitenste schil van een atoom een elektron opneemt of afstaat. Als dit gebeurt, is het atoom natuurlijk niet neutraal meer. Een geladen atoom noemen we een ion.
Elektronen zijn negatief geladen, dus als een atoom een extra elektron opneemt, dan verandert het neutrale atoom in een negatief geladen ion. Als een atoom een elektron afstaat, dan wordt het aantal positieve protonen groter dan het aantal negatieve elektronen en als gevolg ontstaat er een positief geladen ion.
De lading van het ion noteren we rechtsboven het symbool. Als een chlooratoom een elektron (e-) opneemt, dan schrijven we Cl-. We noemen dit een chloride-ion. Als een natriumatoom een elektron (e-) afstaat, dan schrijven we Na+. We noemen dit een natriumion. Merk op dat de naam van negatieve ionen eindigt op "-ide-ion" en voor positieve ionen alleen op "-ion".
Een atoom kan ook meerdere elektronen opnemen of afstaan. Als een fosforatoom bijvoorbeeld drie elektronen opneemt, dan ontstaat er P3-. We noemen dit een fosfide-ion.
Het aantal elektronen dat een atoom bij een reactie opneemt of afstaat is niet willekeurig. De atomen in de eerste kolom van het periodiek systeem staan gemakkelijk 1 elektron af en krijgen daarom een lading van 1+. De atomen in de tweede en derde kolom krijgen gemakkelijk een lading van 2+ en 3+ (zie de onderstaande afbeelding). Ook aan de rechterkant is een dergelijk patroon zichtbaar. De niet-metalen in de tweede kolom van links krijgen lading 1-, de derde kolom 2- en de vierde kolom 3-. Let er op dat de edelgassen geen ionen vormen (deze atomen zijn immers niet reactief).

Voor de vakjes in het periodiek systeem die wit zijn gelaten, is een minder duidelijk patroon te vinden. In deze gevallen vermelden we de lading met behulp van Romeinse cijfers. Een ijzer(III)ion staat bijvoorbeeld voor Fe3+ en een ijzer(II)ion voor Fe2+. De Romeinse cijfers staan altijd voor het aantal positieve ladingen.
 Zorg dat je kan redeneren met atomen en ionen en dat je de lading van een ion kan achterhalen met het periodiek systeem en met behulp van de Romeinse cijfers in de naamgeving
Zorg dat je kan redeneren met atomen en ionen en dat je de lading van een ion kan achterhalen met het periodiek systeem en met behulp van de Romeinse cijfers in de naamgeving
|
|
§3 Zouten
Nu we weten wat ionen zijn, zijn we eindelijk in staat te begrijpen wat zouten zijn. Dit gaan we bestuderen in deze paragraaf.
Als een metaalatoom met een niet-metaalatoom reageert, dan ontstaat altijd een zout. Het bekendste voorbeeld van een zout is keukenzout. Als we keukenzout ontleden, dan vinden we inderdaad dat het opgebouwd is uit een metaal en een niet-metaal. In dit geval gaat het om het metaal natrium dat explosief reageert met water en het gele en giftige gas chloor. Als we deze stoffen weer met elkaar laten reageren, dan ontstaat weer keukenzout.

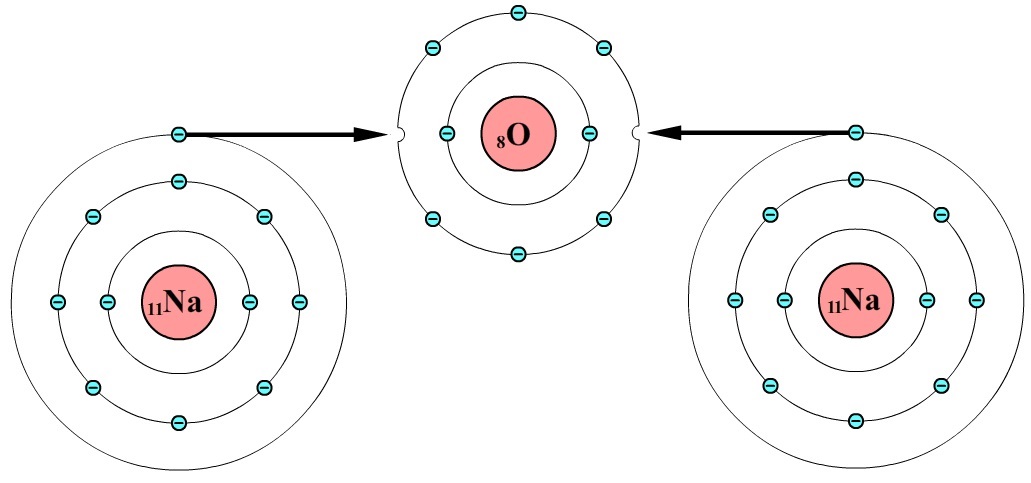
Als een metaalatoom en een niet-metaalatoom met elkaar reageren, dan veranderen beide atomen in ionen. Als bijvoorbeeld een natriumatoom met een chlooratoom reageert, dan pakt het chlooratoom een elektron af van het natriumatoom. Als gevolg ontstaat een natriumion (Na+) en een chloride-ion (Cl-) (zie de onderstaande afbeelding).

Omdat positieve en negatieve ladingen elkaar aantrekken, zal een natriumion zich omringen door chloorionen en andersom. Het resultaat is een hecht rooster waarin de chloorionen en de natriumionen elkaar afwisselen. We noemen dit een ionrooster (zie de onderstaande afbeelding).
 (Afbeelding: Benjah-bmm27; PD)
(Afbeelding: Benjah-bmm27; PD)
Samen met de kennis uit het vorige hoofdstuk weten we dus nu dat metalen uit metaalatomen bestaan en zich ordenen in een metaalrooster, dat niet-metalen bestaan uit niet-metaalatomen en zich ordenen als moleculen en dat zouten bestaan uit een combinatie van metaalatomen en niet-metaalatomen en zich ordenen in ionroosters. Dit is hieronder samengevat:
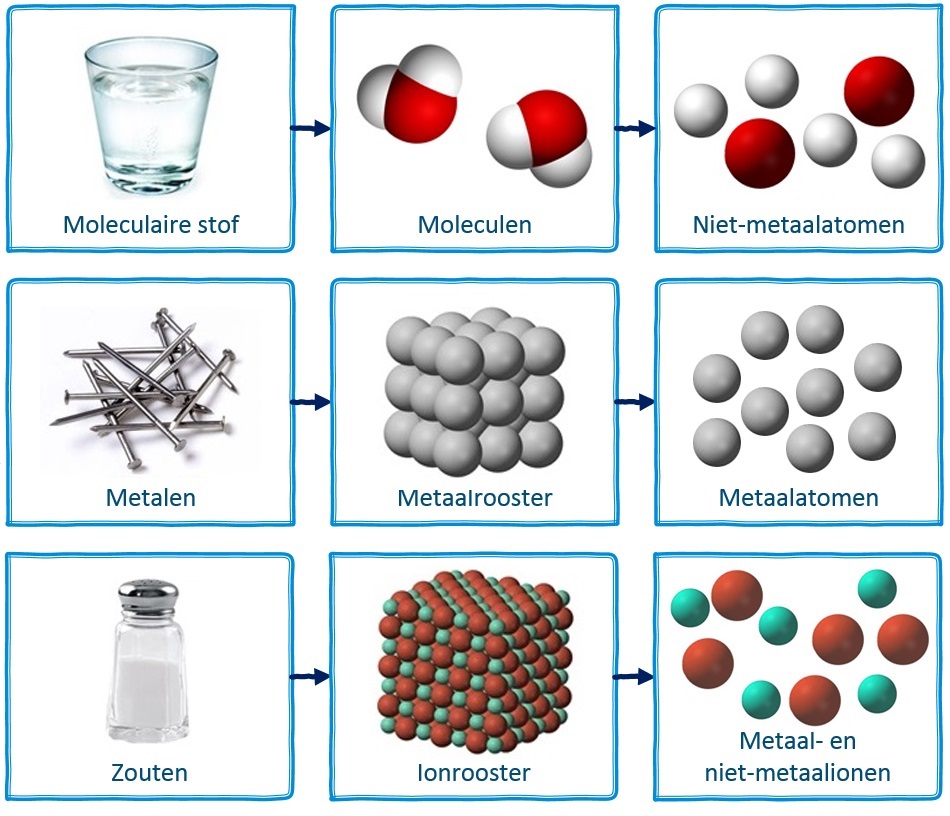
Zowel moleculen, metaalroosters als ionroosters vinden we terug bij de ontleding van keukenzout. Keukenzout zelf vormt een ionrooster. Het natrium dat ontstaat vormt een metaalrooster en het chloorgas vormt moleculen (Cl2):

Zouten vormen geen moleculen en dus kunnen we er ook geen molecuulformules voor opstellen. We kunnen voor zouten wel een verhoudingsformule opstellen. Deze formule geeft aan in welke verhouding de verschillende ionen aanwezig zijn in het ionrooster. Neem bijvoorbeeld keukenzout. Natriumionen hebben een lading van 1+. Chloride-ionen hebben een lading van 1-. Omdat keukenzout een neutrale stof is, moeten er dus evenveel natriumionen als chloride-ionen in een keukenzout zitten. De verhoudingsformule van keukenzout wordt dus simpelweg Na+Cl-. In de praktijk laten we de ladingen in de verhoudingsformule weg en korten we dit af tot NaCl.
Nog een voorbeeld. Natriumoxide bestaat uit natriumionen (Na+) en oxide-ionen (O2-):
$$ \mathrm{O}^{2-} \,\,\, \mathrm{Na}^+ $$Natriumoxide is een neutrale stof. Als beide ionen evenveel aanwezig zouden zijn, dan zou het resultaat niet neutraal zijn. Het totaal is wel neutraal als het zout twee keer zoveel natriumionen zou bevatten:
$$ \mathrm{O}^{2-} \,\,\, \mathrm{Na}^+ \,\,\, \mathrm{Na}^+$$De verhoudingsformule van natriumoxide is daarom Na2O. Bij de vorming van dit zout hebben beide natriumatomen elk een elektron afgestaan (zodat ze lading 1+ krijgen) en heeft het zuurstofatoom deze twee elektronen opgenomen (zodat het een lading van 2- krijgt). Hieronder staat deze reactie schematisch weergegeven:
Laten we nog een laatste voorbeeld bespreken. Wat is de verhoudingsformule van aluminium(III)oxide? Een aluminiumion heeft een lading van 3+ en een oxide-ion heeft een lading van 2-:
$$ \mathrm{Al}^{3+} \,\,\, \mathrm{O}^{2-} $$Om een neutraal stuk aluminium(III)oxide over te houden, hebben we twee aluminiumionen nodig en drie oxide-ionen:
$$ \mathrm{Al}^{3+} \,\,\, \mathrm{Al}^{3+} \,\,\, \mathrm{O}^{2-} \,\,\, \mathrm{O}^{2-} \,\,\, \mathrm{O}^{2-} $$De verhoudingsformule wordt dus Al2O3.

We kunnen de verhoudingsformules ook in woorden uitdrukken. We gebruiken hier niet de Griekse voorvoegsels. Na2O noemen we gewoon natriumoxide en Al2O3 noemen we aluminium(III)oxide. De romeinse cijfers worden hier genoteerd omdat de ionlading van aluminium niet rechtstreeks uit het periodiek systeem af te lezen is.
 Zorg dat je de verhoudingsformule van zouten kan achterhalen en zorg dat je in het VWO ook de uitwisseling van elektronen bij de vorming van een ionrooster kan schetsen
Zorg dat je de verhoudingsformule van zouten kan achterhalen en zorg dat je in het VWO ook de uitwisseling van elektronen bij de vorming van een ionrooster kan schetsen
|
|
§4 Oplossen van zouten
Als we een zout oplossen in bijvoorbeeld water, dan gaan de ionen vrij door de vloeistof bewegen. Dit bestuderen we in deze paragraaf.
Hieronder zien we een watermolecuul. Zoals je kunt zien bevinden er aan de bovenkant een aantal elektronen en aan de onderkant een aantal protonen. Dit zorgt ervoor dat de bovenkant van een watermolecuul een kleine negatieve lading heeft en de onderkant een kleine positieve lading.

Als we een zout in water oplossen, dan trekken de watermoleculen met de twee geladen kanten aan de ionen in het zout. Als deze aantrekkingskracht groot genoeg is, dan trekken de watermoleculen de ionen uit het rooster. De ionen bewegen dan vrij rond in het water (zie de onderstaande afbeelding).
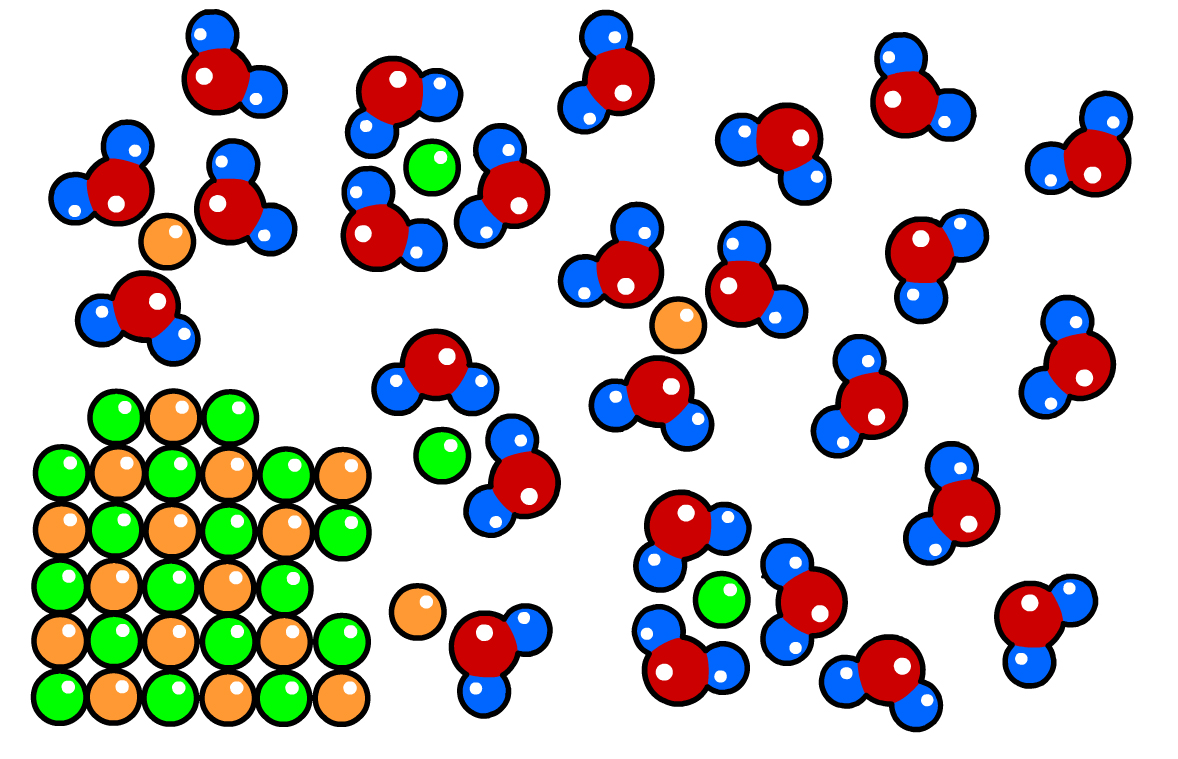
De reactievergelijking voor het oplossen van een zout schrijven we als volgt op:
$$ \text{NaCl (s) } \rightarrow \text{ Na}^+\text{ (aq) } + \text{Cl}^-\text{ (aq)} $$In een eerder hoofdstuk hebben we gezien dat (s) staat voor een vaste stof. Met (aq) geef je aan dat de ionen in water ("aqua") zijn opgelost. Er staat hier dus dat het ionrooster is opgedeeld in individuele ionen, die vrij rondbewegen in water.
Doordat ionen geladen deeltjes zijn, kunnen zouten in vloeibare vorm elektriciteit geleiden. Dit kunnen we aantonen met een experiment. Zet een lamp in serie met de vloeistof en laat er een stoom doorheen lopen. Als de vloeistof geleid, dan gaat de lamp aan en anders niet. Als je dit experiment uitvoert met gedestilleerd water (waar geen zouten in zijn opgelost) dan gaat de lamp niet aan. Als je een zout toevoegt aan het gedestilleerd water dan gaat het lampje wel aan. Dit is ook waarom kraanwater geleid—door de ionen die in dit water zijn opgelost. Zonder deze ionen zou water geen stroom geleiden.
 Zorg dat je reactievergelijkingen kan noteren waarbij een zout wordt opgelost
Zorg dat je reactievergelijkingen kan noteren waarbij een zout wordt opgelost
|
|

