Hoofdstuk 2
Zuren en basen
§1 Zuren en basen §2 Schoonmaken §3 Waterstofionen §4 Zuur-basereacties §5 Titreren
§1 Zuren en basen
In deze paragraaf introduceren we zuren, basen en pH-neutrale stoffen.
In het dagelijks leven komen we veel zuren tegen. Citroensap en azijn worden bijvoorbeeld geregeld gebruikt in maaltijden. Zoutzuur is het zuur waarmee eten verteerd wordt in je maag. Basische stoffen ken je ook. Zeep is een voorbeeld van een basische stof. Je hebt zeep vast wel eens per ongeluk geproefd. De zeepsmaak is kenmerkend voor veel basische stoffen.

Hoe zuur of hoe basisch een stof is geven we aan met een getal genaamd de zuurgraad, ook wel de pH-waarde genoemd. Er geldt:
- Zuren hebben een pH onder de 7. Hoe lager de pH, hoe zuurder de stof.
- Basen hebben een pH-waarde van boven de 7. Hoe hoger de pH, hoe meer basisch de stof.
- Stoffen met een pH van 7 noemen we pH-neutraal. Deze stoffen zijn niet zuur en niet basisch. Het bekendste voorbeeld hiervan is water.
We kunnen de zuurgraad van een stof bepalen met behulp van een indicator. Een bekend voorbeeld hiervan is rodekoolsap. Hieronder is rodekoolsap toegevoegd aan een aantal stoffen met toenemende pH-waarde van links naar rechts. Met behulp van een chemische reactie verkleurt de sap afhankelijk van de pH-waarde. Rodekoolsap wordt rood in erg zure stoffen en geel in erg basische stoffen.
 (Afbeelding; Epaenurk; CC BY-SA 3.0)
(Afbeelding; Epaenurk; CC BY-SA 3.0)
Andere voorbeelden van indicatoren zijn lakmoes en fenolftaleïne. Lakmoes wordt vaak aangebracht op een dun strookje papier. Een druppel van een zuur op dit papier maakt het rood en een druppel van een base maakt het blauw. Fenolftaleïne blijft kleurloos in een zuur en wordt paars in een basische stof. Voor een heel aantal indicatoren zijn de kleurovergangen te vinden in BINAS.
Een erg nauwkeurige manier om de pH-waarde te bepalen is met universeel indicatorpapier. Als je een stof in aanraking brengt met dit papier, dan verkleurt het. Bij een rolletje indicatorpapier is een legenda afgebeeld waarop je kan zien welke pH-waarde hoort bij welke kleur (zie de onderstaande afbeelding).
 (Afbeelding: AGeremia CC BY-SA 4.0)
(Afbeelding: AGeremia CC BY-SA 4.0)
Hieronder zien we een aantal stoffen met de bijbehorende pH-waarde en de kleur van het universeel indicatorpapier:
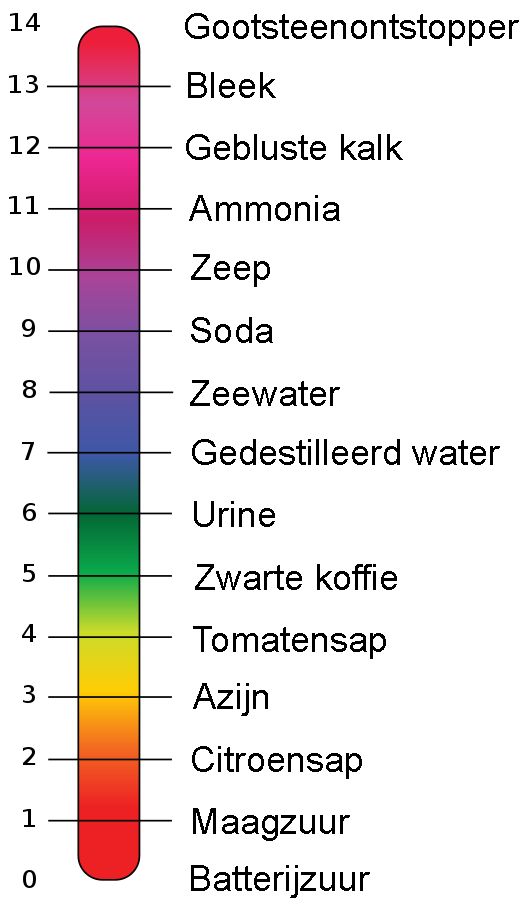 (Afbeelding: Edward Stevens; CC BY 3.0-mod)
(Afbeelding: Edward Stevens; CC BY 3.0-mod)
In de onderstaande tabel zijn een aantal zuren en basen te vinden die je uit je hoofd moet kennen:
| Zuur | Base | ||
| Triviale naam | Chemische formule | Triviale naam | Chemische formule |
| Zoutzuur | HCl | Natronloog | NaOH (aq) |
| Salpeterzuur | HNO3 | Kalkwater | Ca(OH)2 (aq) |
| Zwavelzuur | H2SO4 | Soda | Na2CO3 |
| Koolzuurhoudend water | H2CO3 (aq) | Ammonia | NH3 (aq) |
| Azijnzuur | HAc | ||
| Fosforzuur | H3PO4 |
Zoutzuur, oftewel waterstofchloride, is in zuivere vorm een gas, maar komt meestal voor opgelost in water. Deze oplossing wordt o.a. in de maag gebruikt bij het verteren van voedsel. De formule voor azijnzuur is eigenlijk CH3COOH, maar dit wordt vaak afgekort tot HAc. Een oplossing van azijnzuur wordt ook wel azijn genoemd. Dit zuur gebruiken we o.a. bij het bereiden van voedsel en als schoonmaakmiddel. Natronloog is een oplossing van natriumhydroxide in water. Dit wordt o.a. gebruikt als gootsteenontstopper. Ammoniak is een gas dat opgelost in water bekend staat als ammonia. Deze oplossing wordt bijvoorbeeld gebruikt bij het verwijderen van vetten en bij het produceren van kunstmest.
In geconcentreerde vorm zijn veel van deze zuren en basen agressief. Ze zijn bijtend en irriterend voor de huid en de slijmvliezen en kunnen in sommige gevallen zelfs brandwonden tot gevolg hebben. In de scheikundeles werk je meestal met sterk verdunde versies van deze zuren, maar ook hier is voorzichtig gebruik noodzakelijk.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Schoonmaken
In het dagelijks leven komen we scheikunde vaak tegen bij het schoonmaken. Vaak zijn schoonmaakmiddelen zuren of basen. In deze paragraaf gaan we hierover leren.
Zoals je weet zijn sommige vlekken gewoon met water schoon te krijgen, maar andere niet. De vlekken die we wel met water wegkrijgen hebben de eigenschap dat ze oplossen in water. Een goed voorbeeld hiervan zijn de suikers in zoete drankjes, zoals limonade. Als je een suikervlek op je shirt krijgt, dan kan je de vlek eerst laten weken in water. Hierdoor lost de suiker in het water op. We zeggen dan dat we water hebben gebruikt als oplosmiddel. Daarna spoelen we het water met de opgeloste suiker weg. Hier zeggen we dat we het water hebben gebruikt als spoelmiddel.
Er is ook vuil dat je niet in water kan oplossen, maar waarbij je water wel kan gebruiken als spoelmiddel. Als je bijvoorbeeld de bladeren van een krop sla haalt, dan zit daar vaak nog een beetje zand op. Dit zand lost niet op in water, maar je kan het wel gemakkelijk wegspoelen met water.

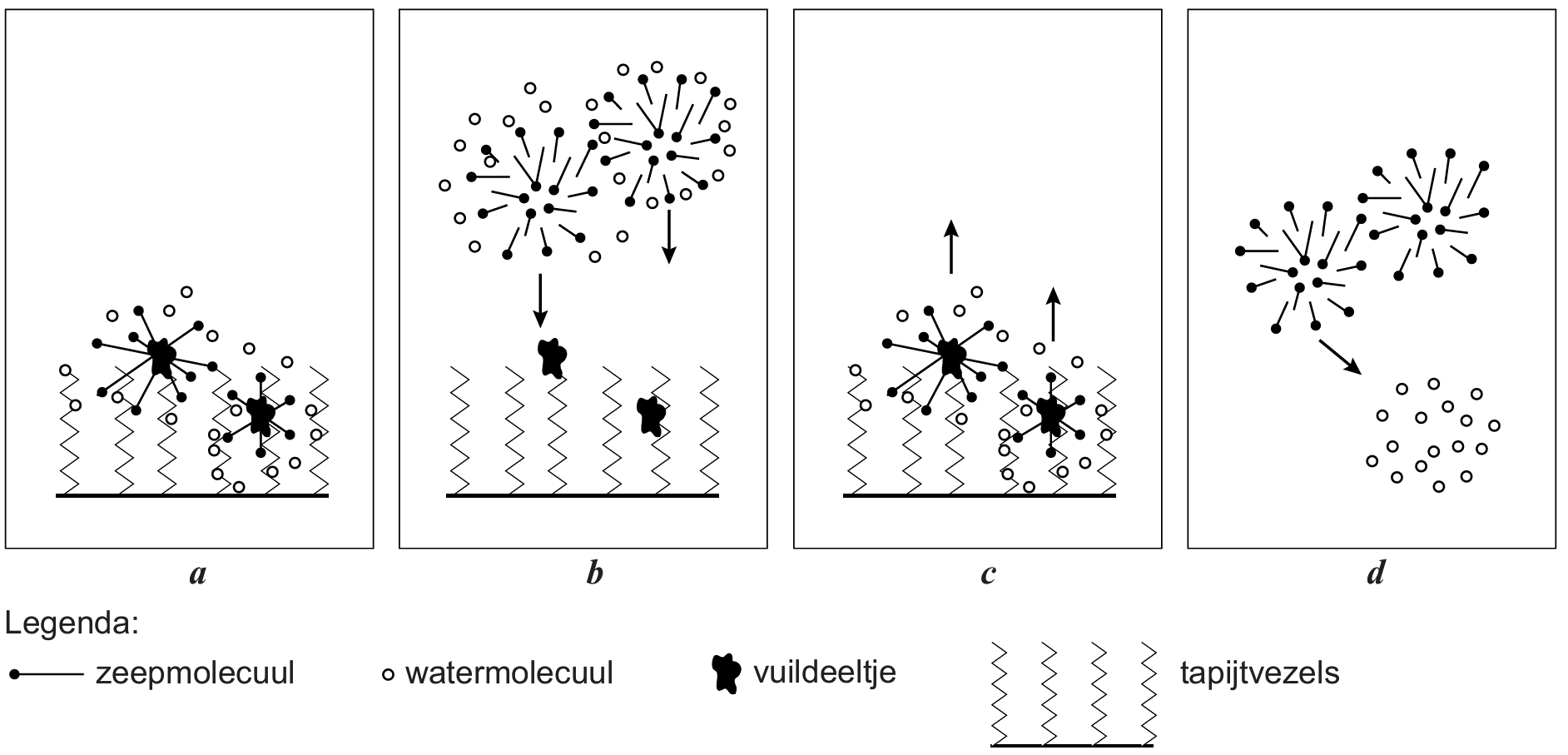
Bij vetvlekken is water niet voldoende. Vet lost niet op in water en vet kan je ook niet wegspoelen met water. We kunnen deze vlekken wel verwijderen met zeep. Zeepdeeltjes hebben een kop en een steel. De steeltjes kunnen niet oplossen in water en komen na verloop van tijd vast te zitten in het vet (zie de rechter afbeelding). De koppen komen aan de buitenkant van het vet te zitten en zijn wel oplosbaar in water. Als gevolg kan het vet nu oplossen in water en daarna kan het water worden weggespoeld.
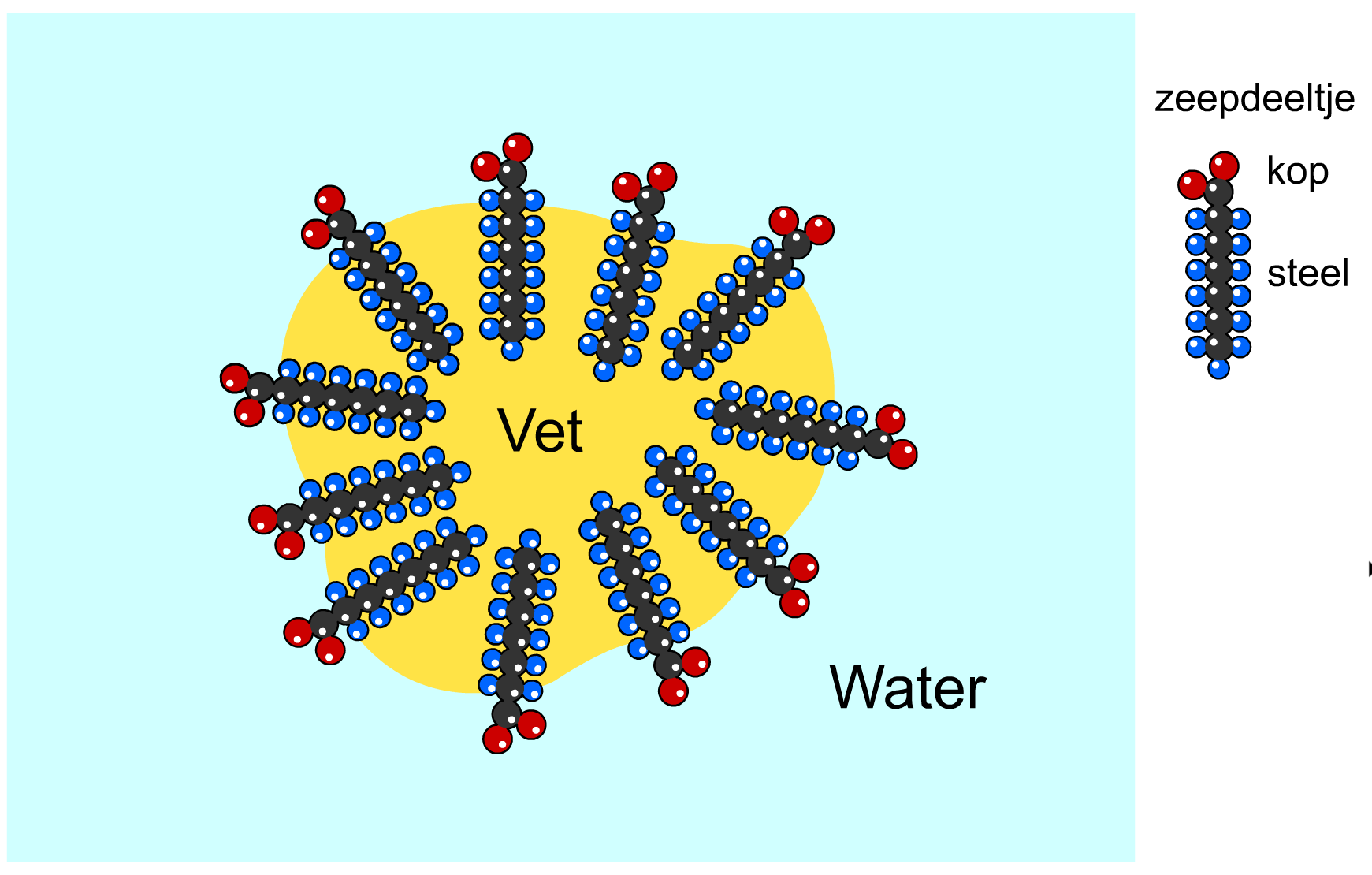
Zoals je weet gebruiken we zeep ook om de huid schoon te maken. Dit werkt erg goed, maar heeft ook nadelen. Er zit namelijk een vettig talglaagje op de huid dat zorgt dat de huid niet uitdroogt. Dit laagje wordt met zeep verwijderd. Het is daarom niet verstandig erg vaak je huid te wassen met zeep.
Naast zeep wordt ook soda gebruikt om vetten te verwijderen. Voor vetten die zelfs met zeep en soda niet oplossen, kan een sterkere basische stof gebruikt worden, bijvoorbeeld natronloog (gootsteenontstopper) of ammonia.
Een ander voorbeeld van een stof die niet oplost in water is nagellak. Om nagellak op te lossen wordt vaak aceton gebruikt. Om verf op te lossen gebruiken we vaak terpentine of wasbenzine.
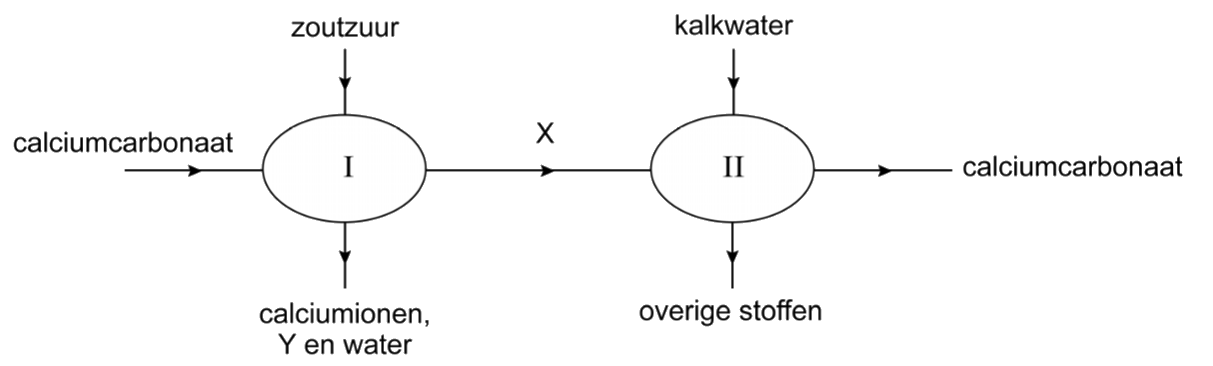
Een ander type vuil waar we in huis graag vanaf willen is kalkaanslag, ook wel ketelsteen genoemd. Zoals je weet zitten in kraanwater allerlei mineralen opgelost. Dit zijn met name calciumionen (Ca2+) en magnesiumionen (Mg2+). We noemen water met veel van deze mineralen ook wel hard water. Deze ionen kunnen reageren met water en koolstofdioxide tot calciumcarbonaat (CaCO3) en magnesiumcarbonaat (MgCO3). Deze stoffen blijven o.a. achter in de vorm van kalkaanslag als hard water verdampt. We zien dit bijvoorbeeld in de badkamer op plekken waar veel water verdampt, zoals bij een kraan (zie de onderstaande linker afbeelding). Een andere plek waar we kalk tegenkomen is bijvoorbeeld op het warmte-element in een waterkoker of wasmachine (zie de rechter onderstaande afbeelding). Omdat kalk warmte slecht geleid maakt dit de wasmachine op den duur minder efficiënt.

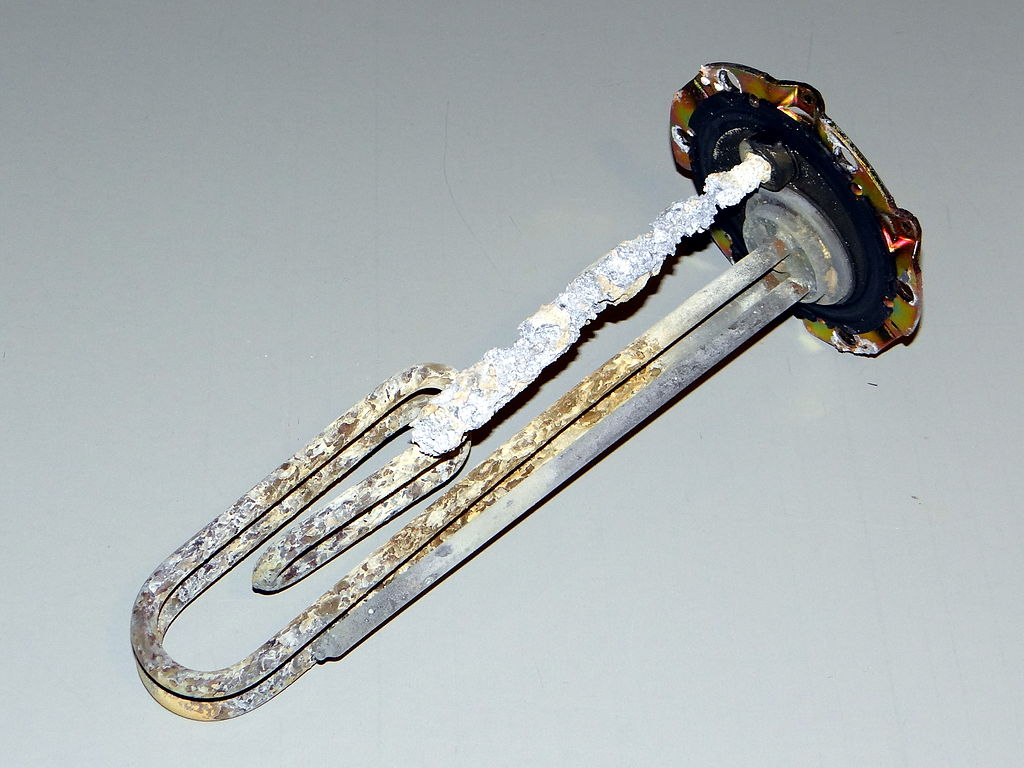 (Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
(Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
Om kalkaanslag te voorkomen heeft het drinkwaterbedrijf al een groot deel van de calcium- en magnesiumionen uit het water verwijderd, maar niet alles. Om te voorkomen dat dit water in de afwasmachine een laagje kalk op je glazen achterlaat, wordt aan veel afwasmiddelen waterontharders toegevoegd. Dit is een stof die met Ca2+ een slecht oplosbaar zout vormt. Een voorbeeld van een ontharder is soda (Na2CO3). De carbonaationen (CO32-) in soda reageren met de calciumionen in het water en zorgen ervoor dat calciumcarbonaat (CaCO3) neerslaat:
$$ \text{Ca}^+ + \text{CO}_3^{2-} \rightarrow \text{CaCO}_3 \text{ (s)} $$De calciumcarbonaat kan je daarna met water gemakkelijk wegspoelen.
Een andere manier om water te ontharden is met een ionenwisselaar. Dit is een voorwerp met aan de buitenkant bijvoorbeeld natriumionen. Calciumionen in het water kunnen de plek innemen van deze natriumionen en zich hechten aan het voorwerp. Op deze manier worden de calciumionen uit het water verwijderd.
Als de kalkaanslag al is gevormd, kunnen we het verwijderen met zuren. Een goed voorbeeld is schoonmaakazijn. Hieronder is bijvoorbeeld azijn gebruikt bij het verwijderen van kalk van het verwarmingselement van een waterkoker.

Hard water heeft ook nog het volgende nadeel. Als hard water in aanraking komt met zeep, dan vormt een witte stof genaamd kalkzeep. Net als kalkaanslag kan ook kalkzeep een aanslag achterlaten nadat het water is verdampt. Dit zorgt er o.a. voor dat je kleding een grauwe kleur krijgt als je het wast met zeep.
Moderne wasmiddelen hebben het voordeel dat ze geen kalkzeep vormen. Dit komt omdat hier gebruik wordt gemaakt van synthetische zeep. Ook zijn moderne wasmiddelen pH-neutraal, wat beter is voor de huid. Moderne wasmiddelen hebben wel het nadeel dat ze slechter zijn voor het milieu.
Als laatste bespreken we schuurmiddel. Hierin zitten fijne korreltjes vaste stof die een schurende werking hebben. Een voorbeeld is garagezeep. Deze zeep wordt gebruikt in garages en werkplaatsen om hardnekkige olie- en vetvlekken te verwijderen. Ook tandpasta bevat een schuurmiddel. Er zit krijt in dat fungeert als een licht schuurmiddel om je tanden schoon te krijgen. Ook zit er in tandpasta trouwens een beetje zeep waarmee vetresten en zuren verwijderd kunnen worden. Deze zuren zijn vaak afkomstig van bacteriën die suiker omzetten in zuur. Daarnaast zit er ook vaak fluoride in tandpasta. Dit helpt het tandglazuur te beschermen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| |||||||||||||||
|
§3 Waterstofionen
In deze paragraaf gaan we begrijpen wat een zuur een zuur maakt en een base een base. Dit heeft alles te maken met waterstofionen.
Zuren
Hieronder zien we nogmaals de tabel met zuren van eerder in dit hoofdstuk. In de tweede kolom van de tabel kan je zien dat elk zuur een waterstofatoom bevat. Dit waterstofatoom noteren we altijd aan het begin van de formule van een zuur. Bij het oplossen van zuren komt het waterstofatoom vrij als een los waterstofion (H+). Dit kan je zien in de derde kolom van de tabel.
| Zuur | Chemische formule | Zuuroplossing |
| Zoutzuur | HCl | H+ (aq) + Cl- (aq) |
| Verdund salpeterzuur | HNO3 | H+ (aq) + NO3- (aq) |
| Verdund zwavelzuur | H2SO4 | 2 H+ (aq) + SO42- (aq) |
| Koolzuurhoudend water | H2CO3 | 2 H+ (aq) + CO32- (aq) |
| Azijn | HAc | H+ (aq) + Ac- (aq) |
| Verdund fosforzuur | HPO4 | H+ (aq) + PO43- (aq) |
Hoe groter de concentratie waterstofionen, hoe zuurder de stof en hoe lager de pH.
Met deze theorie kunnen we o.a. begrijpen waarom frisdrank een zure smaak heeft. In frisdrank zit namelijk koolstofdioxide (dit is de "prik" in frisdrank) en dit kan de volgende reactie aangaan met water:
$$ \text{CO}_2 + \text{H}_2\text{O} \rightarrow \text{2 H}^+ + \text{CO}_3^{2-} $$Aan de rechterkant van de vergelijking zien we twee losse waterstofionen. Dit zorgt voor de zure smaak. Als we in de bovenstaande tabel kijken, dan herkennen we de oplossing die ontstaat als koolzuurhoudend water. We noemen frisdranken daarom ook wel koolzuurhoudende dranken.
We kunnen met zuren ook metalen oplossen. In de onderstaande afbeelding zien we bijvoorbeeld een stukje zink dat in zoutzuur is gelegd. De waterstofionen van het zoutzuur reageren met zink en als gevolg lost het zink op. De reactie schrijven we als volgt op:
$$ \text{Zn(s)} + \text{2 H}^+\text{(aq)} \rightarrow \text{Zn}^{2+}\text{(aq)} + \text{H}_2 \text{(g)} $$

 EXPERIMENT
EXPERIMENT
| ||
|
Zoals je ziet zijn de zinkatomen (Zn) in het metaal nu omgezet in zinkionen (Zn2+). Ook zien we aan de hand van de toestandsaanduiding "aq" dat deze ionen zijn opgelost in water. Zoals je kan zien is bij de reactie ook waterstofgas (H2) ontstaan. Dit is de oorzaak van de belletjes in de rechter foto.
Het oplossen van metalen wordt o.a. gebruikt bij etsen. Vroeger werd met deze techniek bijvoorbeeld een tekening van groeven in metaal gemaakt. Op het metaal werd eerst een waslaag aangebracht. Met een naald werd dan in deze laag een tekening gemaakt, waarbij het was werk weggekrast. Daarna werd een zuur aangebracht. Alleen op de plekken waar de waslaag weggekrast was, loste het metaal op. Het metaal dat overbleef kon dan dienen als een stempel om meerdere afdrukken te maken. Zie het onderstaande filmpje.

 EXPERIMENT
EXPERIMENT
| ||
|
Basen
Laten we nu basen bespreken. Basen kunnen juist gemakkelijk waterstofionen opnemen als deze in de buurt zijn. Dit geldt o.a. voor hydroxide-ionen (OH-), zuurstofionen (O2-), carbonaationen (CO32-) en ammoniak (NH3):
| Base | Chemische formule | Voorbeeld |
| Hydroxide-ion | OH- | Natronloog: Na+ (aq) + OH- (aq) Kalkwater: Ca2+ (aq) + OH-(aq) |
| Oxide-ion | O2- | - |
| Carbonaation | CO32- | Soda-oplossing: 2 Na2+ (aq) + CO32- (aq) Koolzuurhoudend water: H+ (aq) + CO32- (aq) |
| Ammoniak | NH3 | Ammonia: NH3 (aq) |
Hoe hoger de concentratie van deze ionen, hoe sterker de base en hoe hoger de pH.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Zuur-basereacties
In deze paragraaf bestuderen we de reactie tussen zuren en basen. We noemen dit zuur-basereacties. Hiermee kunnen zuren en basen geneutraliseerd worden.
Stel we laten natronloog (Na+ (aq) + OH- (aq)) reageren met bijvoorbeeld zoutzuur (H+ (aq) + Cl- (aq)). In dit geval herkennen we het hydroxide-ion (OH-) in natronloog als een base en het waterstofion (H+) in zoutzuur als het zuur. Als we deze twee ionen laten reageren, dan ontstaat water:
$$ \text{OH}^- + \text{H}^+ \rightarrow \text{H}_2\text{O} $$Merk op dat de natriumionen (Na+) en de chloride-ionen (Cl-) in de bovenstaande reactie niet genoemd zijn. Dit komt omdat deze ionen gewoon opgelost blijven in het water en geen reactie ondergaan.
Merk op dat bij deze reactie zowel het zuur als de base verdwenen is. Met een zuur kan je dus een base neutraliseren en andersom. Als we een base toevoegen aan een zuur, dan wordt de stof minder zuur. De pH van het zuur gaat dan omhoog. En als we een zuur toevoegen aan een base, dan wordt de stof minder basisch. De pH van de base gaat dan omlaag.
Een voorbeeld van een zuurbase-reactie is het verwijderen van kalkaanslag met behulp van een zuur. Deze reactie ziet er als volgt uit:
$$ \text{CaCO}_3\text{ (s)} + \text{2 H}^+ \rightarrow \text{Ca}^{2+}\text{(aq)} + \text{H}_2\text{O} + \text{CO}_2 $$In dit geval reageren de basische carbonaationen (CO32-) in ketelsteen (CaCO3) met de waterstofionen (H+) van een zuur. De calciumionen die hierbij ontstaan zijn in het water opgelost en kan je dus gemakkelijk wegspoelen.
Deze reactie wordt ook gebruikt als mensen te veel maagzuur produceren. Met een basisch medicijn genaamd een Rennie, bestaande uit o.a. carbonaationen, kan een deel van dit zuur geneutraliseerd worden. Een ander voorbeeld is het neutraliseren van verzuurde grond met kalkwater. Tandenpoetsen werkt ook neutraliserend. Bacteriën in de mond produceren namelijk zuren die door de tandpasta geneutraliseerd worden.
Voor redenen die te ver gaan om in dit hoofdstuk te bespreken gedraagt ammonia (NH3 (aq)) zich ook als een base. Als het reageert met een zuur, dan vormt ammonium (NH4+):
$$ \text{NH}_3 + \text{H}^+ \rightarrow \text{NH}_4^+ $$
 Voorbeeld
Voorbeeld
|
|
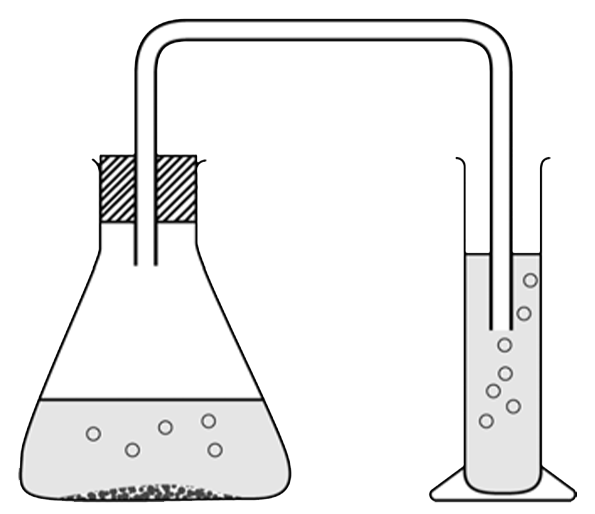
Vraag: Een leerling voegt zoutzuur en een klein schepje calciumcarbonaat in een erlenmeyer. Direct daarna sluit hij de erlenmeyer af met een kurk waar een glasbuisje doorheen steekt met een slangetje eraan (zie de onderstaande afbeelding). Het slangetje leidt naar een maatcilinder die helder kalkwater bevat. Leg uit hoe je aan de erlenmeyer kan zien dat er een gas ontstaat bij de reactie en leg uit hoe je aan de maatcilinder kan zien dat dit gas koolstofdioxide is.
Antwoord: Het mengsel in de erlenmeyer begint te bruisen. Dit duidt op het ontstaan van een gas. In de maatcilinder wordt het kalkwater troebel. Dit duidt op de aanwezigheid van koolstofdioxide. Vraag: Leg uit dat in de erlenmeyer een zuur-basereactie plaatsvindt. Geef in de uitleg de ionen die de gebruikte stoffen zuren en basen maken. Antwoord: Zoutzuur is een zuur omdat het H+-ionen bevat. Calciumcarbonaat bevat CO32--ionen en dit maakt deze stof basisch. Als deze twee stoffen reageren, dan vindt dus een zuur-basereactie plaats. Vraag: In het kalkwater reageert koolstofdioxide met water tot koolzuur. Dit reageert daarna met het kalkwater tot calciumcarbonaat en water. Leg uit dat ook dit een zuur-basereactie is. Geef in de uitleg de ionen die de gebruikte stoffen zuren en basen maken. Antwoord: Koolzuur is H2CO3 en bevat H+-ionen. Dit maakt deze stof een zuur. Calciumcarbonaat is Ca(OH)2 en bevat OH--ionen. Dit maakt deze stof een base. Als deze twee stoffen reageren, dan vindt dus een zuur-basereactie plaats.
|
 EXPERIMENT
EXPERIMENT
| ||
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Titreren
Met behulp van een techniek genaamd titratie kunnen we achterhalen hoeveel van een bepaald zuur of een bepaalde base in een vloeistof is opgelost. In deze paragraaf gaan we leren hoe dit werkt.
Hieronder zien we een opstelling waarmee een zogenaamde titratie kan worden uitgevoerd. Titratie is een methode om te achterhalen hoeveel van een bepaald zuur of een bepaalde base in een oplossing aanwezig is. Het werkt als volgt. We stoppen het zuur of de base in een erlenmeyer en voegen een indicator toe. Als we een zure vloeistof hebben, dan voegen we daarna met behulp van een buret nauwkeurig een hoeveelheid basische stof toe. Als we een basische stof hebben, dan voegen we juist een zuur toe. Dit doen we totdat de kleur van de indicator omslaat .
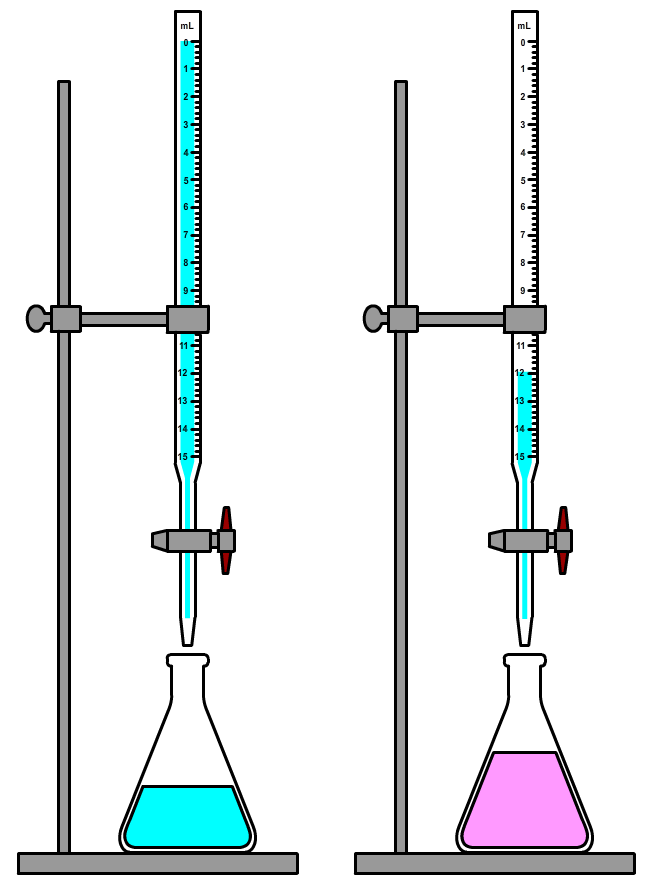
Als indicator kan je bijvoorbeeld een paar druppels fenolftaleïne gebruiken. Deze indicator is kleurloos in een zuur en paars in een base. Als we een zure vloeistof hebben, dan voegen we daarna met behulp van een buret nauwkeurig een hoeveelheid basische stof toe. Voeg telkens een beetje van de base toe en schud dan goed, zodat de base zich goed kan verspreiden. Ga door totdat de fenolftaleïne net een beetje paars begint te kleuren en ook paars blijft na het schudden (zie de onderstaande afbeelding). Het omslagpunt van fenolftaleïne vindt plaats rond een pH van 7. Op dit moment is de stof neutraal geworden. Dit vertelt ons dat nu al het zuur is geneutraliseerd.

 EXPERIMENT
EXPERIMENT
| ||
|
Laten we hier nu mee rekenen. Een leerling wil weten hoeveel azijnzuur er in 50 mL keukenazijn zit. De keukenazijn wordt hiervoor met een paar druppels fenolftaleïne in een erlenmeyer gedaan. Met een titratie bleek 42 mL natronloog nodig te zijn tot het omslagpunt bereikt is. Gegeven is dat 1 mL natronloog reageert met 44 mg azijnzuur (dit staat vermeld in de vraag). We kunnen hiermee uitrekenen hoeveel mg azijnzuur er in de keukenazijn zat:
| Volume natronloog | 1 mL | 42 mL |
| Massa azijnzuur | 44 mg | 1848 mg |
Er zit dus 1848 mg = 1,8 gram azijnzuur in 50 mL keukenazijn.
 Voorbeeld
Voorbeeld
| ||||||||||||
|
Vraag: Een leerling wil het zuurgehalte van 10 mL wijn bepalen met behulp van een titratie. Ze gebruikt hiervoor de indicator fenolftaleïne. Leg uit waarom de wijn eerst ontkleurt moet worden met actieve kool. Antwoord: Door de donkerrode kleur van de wijn kan anders de kleuromslag van het fenolftaleïne niet zichtbaar worden gemaakt. Vraag: De leerling giet de ontkleurde wijn in een erlenmeyer met een paar druppels fenolftaleïne. Wat is de kleur van dit mengsel? Antwoord: Volgens BINAS heeft fenolftaleïne in een zuur de kleur wit. Eigenlijk is het mengsel kleurloos. Vraag: Met een buret wordt natronloog toegevoegd. Geef de reactievergelijking van de zuur-basereactie die hierdoor plaatsvindt. Vermeld ook de toestandsaanduidingen. Antwoord: In natronloog zit het ion OH-. En in elk zuur (en dus ook het zuur in de wijn) zit het ion H+. De reactie wordt: $$ \text{OH}^- \text{ (aq)} + \text{H}^+ \text{ (aq)} \rightarrow \text{H}_2\text{O} \text{ (l)} $$Vraag: Nadat 9,0 mL natronloog is toegevoegd aan 10 mL wijn wordt de kleuromslag van fenolftaleïne bereikt. 1,0 mL natronloog reageert met 6,0 mg zuur. Bereken het aantal gram zuur in een liter wijn. Antwoord: Er is 9,0 mL natronloog nodig om de wijn te neutraliseren. Elke mL natronloog komt overeen met 6,0 mg zuur. Voor 9,0 mL natronloog geldt dan:
Er zit dus 54 mg zuur in 10 mL wijn. In een liter
Er zit dus 5400 mg = 5,4 g zuur in een liter wijn. Noteer het antwoord in twee significante cijfers.
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
|
Samengestelde ionen |
|
|
carbonaat-ion |
CO32- |
|
nitraat-ion |
NO3- |
|
sulfaat-ion |
SO42- |
|
fosfaat-ion |
PO43- |
|
hydroxide-ion |
OH- |
|
Ammonium-ion |
NH4+ |
|
Zouten |
||
|
Keukenzout |
Natriumchloride |
NaCl |
|
Kalkwater |
Calciumhydroxide |
Ca(OH)2 (aq) |
|
Kalksteen |
Calciumcarbonaat |
CaCO3 |
|
Soda |
Natriumcarbonaat |
Na2CO3 |
|
Natronloog |
Natriumhydroxide |
NaOH (aq) |
|
Zuren |
Basen |
||
|
Triviale naam |
Formule |
Triviale naam |
Formule |
|
Zoutzuur |
HCl (aq) |
Natronloog |
NaOH (aq) |
|
Salpeterzuur |
HNO3 |
Kalkwater |
Ca(OH)2 (aq) |
|
Zwavelzuur |
H2SO4 |
Soda |
Na2CO3 |
|
Koolzuur |
H2CO3 |
Ammonia |
NH3 (aq) |
|
Azijnzuur |
HAc |
|
|
|
Fosforzuur |
H3PO4 |
|
|
|
Zuur-ionen |
Base-ionen |
|
H+ |
OH- |
|
|
O2- |
|
|
CO32- |
|
|
NH3 |
| BINAS: | |
| 33 | Elementen en symbolen |
| 34 | Periodiek systeem |
| 36 | Zuur-base-indicatoren |
| 42 | Triviale en rationele namen stoffen |