Hoofdstuk 8
Massaverhoudingen
§1 Relatieve atoommassa §2 Behoud van massa en massaverhouding §3 Overmaat
§1 Relatieve atoommassa
In dit hoofdstuk gaan we rekenen aan chemische reacties met behulp van het begrip massa. We beginnen in de eerste paragraaf met het bestuderen van de massa van atomen en moleculen.
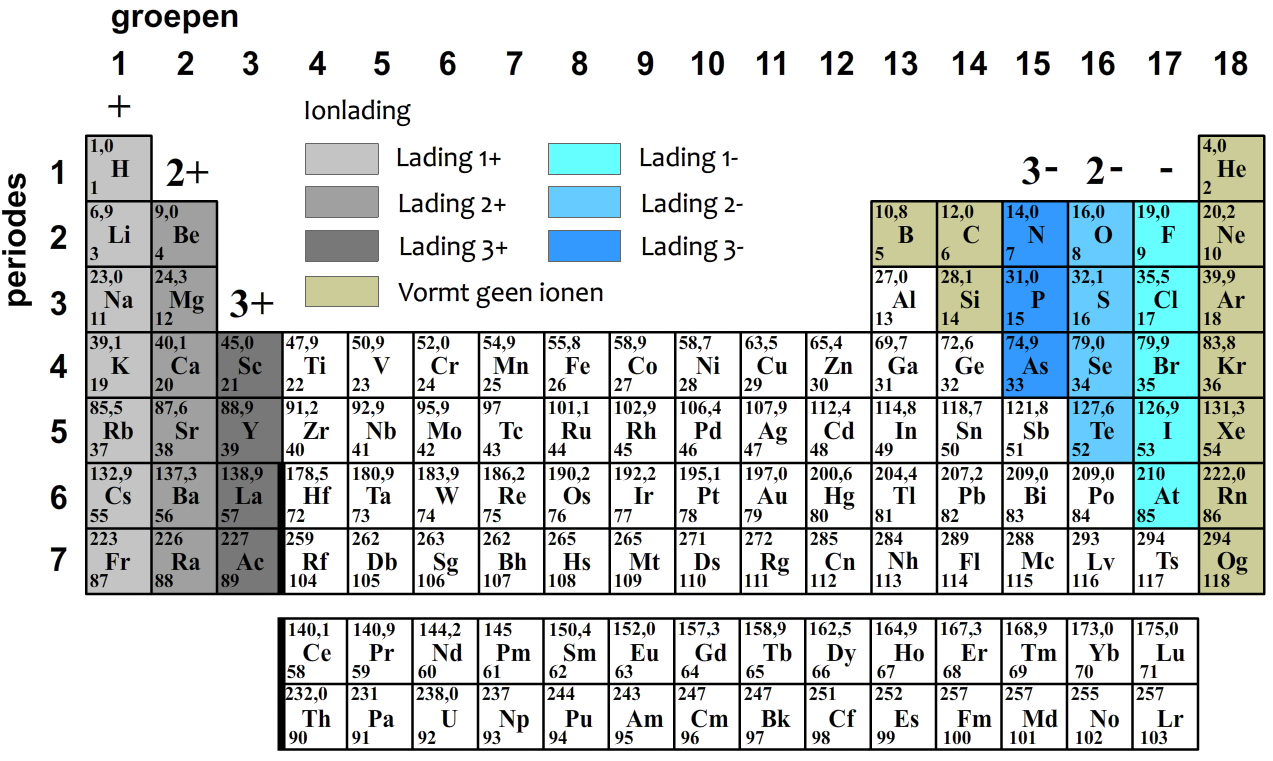
In een eerder hoofdstuk hebben we geleerd dat elke atoomsoort wordt gekenmerkt door een vast aantal protonen in de kern. Het aantal protonen in de kern wordt ook wel het atoomnummer genoemd. In het onderstaande periodiek systeem staat het atoomnummer linksonder elk element genoemd.
Het aantal protonen en neutronen samen noemen we het massagetal. Zoals we in een eerder hoofdstuk geleerd hebben staat het massagetal van een bepaald element staat niet vast. De meestvoorkomende massagetallen van Neon zijn bijvoorbeeld 20 en 22. We noemen dit twee isotopen van neon.
De massa van atomen geven we meestal niet in kilogram, maar in atomaire massaeenheid (u). Voor de massa kijken we alleen naar de protonen en de neutronen en niet naar de elektronen, want deze deeltjes zijn veel lichter en dragen daarom zo goed als niks bij aan de massa. Zowel een proton als een neutron wegen beide rond de 1,0 u. Er geldt:
$$ 1 \text{ u} = 1,66 \times 10^{-27} \text{ kg} $$Doordat een proton en een neutron elk een massa hebben van ongeveer 1,0 u, komt de massa van atomen in u redelijk overeen met het massagetal. Als we op aarde echter een bepaalde hoeveelheid van een stof hebben, dan bestaat dit meestal uit een mix van isotopen. Om de massa van een atoom te bepalen wordt dan het gemiddelde genomen van de verschillende massa's van de isotopen, waarbij rekening wordt gehouden met hoe vaak ze voorkomen. Deze gemiddelden worden de relatieve atoommassa genoemd en ze staan voor alle elementen vermeld in het bovenstaande periodieke systeem linksboven het element in u. Deze gemiddelden kan je ook in BINAS vinden.
Met deze kennis kunnen we bijvoorbeeld de massa van het gemiddelde watermolecuul berekenen. De molecuulformule van water is H2O. Het bestaat dus uit twee waterstofatomen (H) met volgens het periodiek systeem elk een massa van 1,0 u en een zuurstofatoom (O) met een massa van 16,0 u. De totale massa is dan 1,0 + 1,0 + 16,0 = 18,0 u. We kunnen dit als volgt naar kilogram omrekenen:
$$ 18,0 \text{ u} \times 1,66 \times 10^{-27} = 2,988 \times 10^{-26} \text{ kg} $$We kunnen nu ook het massapercentage van de waterstof en de zuurstof in water uitrekenen. Omdat de massa van het zuurstofatoom 16,0 u is en de massa van water 18,0, is het massapercentage zuurstof in water:
| Massa | 18,0 u | 16,0 u |
| Massaprocent | 100 % | 88,9 % |
De twee waterstof atomen hebben samen een massa van 1,0 + 1,0 = 2,0 u. Op een soortgelijk manier vinden we het massapercentage van waterstof:
| Massa | 18,0 u | 2,0 u |
| Massaprocent | 100 % | 11,1 % |
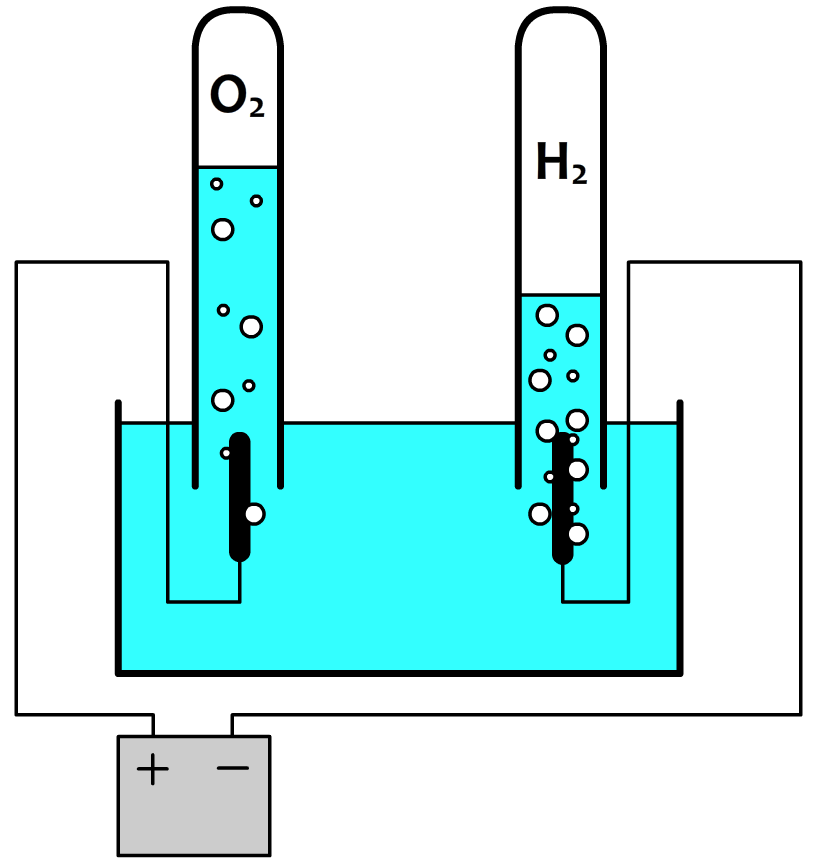
Dit zijn trouwens precies te percentages die we vinden als we water ontleden door middel van elektrolyse in zuurstofgas (O2) en waterstofgas (H2). Als we beide gassen wegen, dan vinden we inderdaad dat voor elke 11,1 gram waterstof die vrijkomt er 88,9 gram zuurstof wordt geproduceerd.
Laten we hetzelfde doen voor bijvoorbeeld kaliumoxide (K2O). Kalium is een metaal en zuurstof een niet-metaal, dus we hebben hier te maken met een zout. Het vinden van de massapercentages werkt echter hetzelfde. Een kaliumion heeft volgens het periodiek systeem een massa van 39,1 u en een oxide-ion een massa van 16,0 u. Omdat we twee kaliumionen hebben in de verhoudingsformule vinden we een totale massa van 39,1 + 39,1 + 16,0 = 94,2 u.
De kaliumionen in de verhoudingsformule hebben een massa van 39,1 + 39,1 = 78,2 u. Het massapercentage kalium in kaliumoxide wordt hiermee:
| Massa | 94,2 u | 78,2 u |
| Massaprocent | 100 % | 83,0 % |
Het massapercentage zuurstof in kaliumoxide is:
| Massa | 94,2 u | 16,0 u |
| Massaprocent | 100 % | 17,0 % |
 Voorbeeld
Voorbeeld
| ||||||||||||
|
Vraag: Per dag wordt in een fabriek 1200 ton bauxiet (Al2O3) verwerkt tot aluminium door middel van elektrolyse. Bereken hoeveel ton aluminium hiermee per dag kan worden geproduceerd. Antwoord: In het periodiek systeem vinden we dat de massa van een aluminiumatoom gelijk is aan 27,0 u. De massa van een zuurstofatoom is 16,0 u. Al2O3 heeft dus een massa van 27,0 + 27,0 + 16,0 + 16,0 + 16,0 = 102,0 u. Het aluminium in dit zout heeft een massa van 27,0 + 27,0 = 54,0 u. Hiermee kunnen we nu het massapercentage aluminium in bauxiet berekenen:
Er wordt in totaal per dag 1200 ton bauxiet verwerkt (1 ton = 1000 kg). Met een verhoudingstabel vinden we hoeveel ton overeenkomt met 52,9411 %:
Er wordt dus 635 ton aluminium geproduceerd per dag (in drie significante cijfers).
|
Leerdoelen:
| ||||||
|
§2 Behoud van massa en massaverhouding
In deze paragraaf bespreken we een belangrijk principe uit de scheikunde genaamd het behoud van massa. We gaan dit principe gebruiken om uit te rekenen in welke massaverhouding verschillende stoffen reageren.
In een eerder hoofdstuk hebben we geleerd dat we de atomen behouden blijven bij een chemische reactie. Dit betekent dat we voor en na de reactie precies dezelfde atomen hebben. Omdat de massa van deze atomen tijdens de reactie ook gelijk blijft, moet de totale massa van de stoffen voor en na de reactie ook gelijk zijn. We noemen dit principe de wet van behoud van massa.
Bij sommige reacties lijkt het in eerst instantie of massabehoud niet geldt. Neem bijvoorbeeld het verbranden van een blok hout. Als je het blok voor en na de verbranding weegt, dan lijkt het alsof er massa verdwenen is. Dit komt echter doordat er bij de verbranding gassen zijn vrijgekomen. Als deze gassen netjes opgevangen worden en gewogen worden, dan blijkt dat de massa netjes gelijk gebleven is.
Nog een voorbeeld. Als een stuk ijzer oxideert, dan wordt het juist zwaarder. Ook hier lijkt massabehoud in eerst instantie niet te gelden, maar bij nadere inspectie blijkt dat het ijzer zuurstof heeft opgenomen uit de lucht. Als deze zuurstof ook gewogen wordt, dan blijkt massabehoud wederom te gelden.
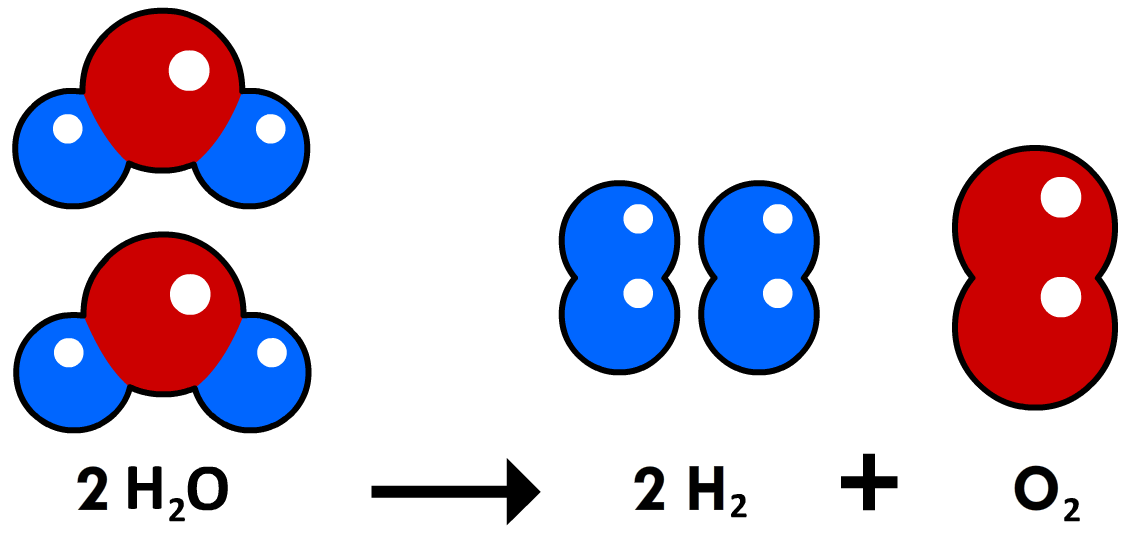
Laten we nu naar reacties kijken. Hieronder zien we het ontleden van water. Bij de ontleding ontstaan 4 waterstofatomen. Volgens het periodiek systeem is de relatieve atoommassa van één waterstofatoom 1,0 u. Voor 4 waterstofatomen geldt dan 1,0 × 4 = 4,0 u. En ontstaat ook 2 zuurstofatomen met een totale massa van 16,0 × 2 = 32,0 u. Waterstofatomen en zuurstofatomen ontstaan bij ontleden dus in de volgende massaverhouding:
$$ 4,0 : 32,0 $$Dat wil zeggen dat als we bij een ontleding bijvoorbeeld 4,0 gram waterstof produceren, dat er dan ook 32,0 gram zuurstof ontstaat. Of als er 4,0 kg waterstof ontstaat, dat er dan ook 32,0 kg zuurstof ontstaat.
Nu bestuderen hiervoor het ontleden van waterstofchloride (HCl) in waterstofgas (H2) en chloorgas (Cl2).
In het periodiek systeem zien we dat een waterstofatoom een relatieve atoommassa van 1,0 u heeft, terwijl een chlooratoom een relatieve atoommassa heeft van 35,5 u heeft. Van beide stoffen ontstaan twee atomen, dus de totale massa is 2 × 1,0 = 2,0 u voor waterstof en 2 × 35,5 = 71,0 u voor chloorgas. We zeggen in zo'n geval dat de massaverhouding tussen het waterstofgas en het chloorgas gelijk is aan:
$$ 2,0 : 71,0 $$Stel dat we bijvoorbeeld 2,25 gram waterstofgas willen maken. Hoeveel gram chloorgas komt hier dan bij vrij? Dit kunnen we nu uitrekenen met een verhoudingstabel:
| Waterstof | 2,0 gram | 2,25 gram |
| Chloor | 71,0 gram | 79,9 gram |
Als we 2,25 gram waterstofgas maken met deze reactie, dan ontstaat er dus ook 79,9 gram chloorgas.
 Voorbeeld
Voorbeeld
| |||||||||
|
Vraag: Een leerling ontleedt 50,0 gram waterstofchloride. Bereken hoeveel gram waterstof en hoeveel gram chloor hier bij vrijkomt. Antwoord: In de bovenstaande tekst hebben we gevonden dat bij het ontleden van waterstofchloride waterstof en chloor vrijkomt in de massaverhouding 2,0 : 71,0. Als we bijvoorbeeld 2,0 gram waterstof produceren, dan ontstaat er ook 71,0 gram chloor. Dankzij massabehoud weten we dat dit geproduceert moet zijn uit 2,0 + 71,0 = 73,0 gram waterstofchloride. We kunnen op basis hiervan de volgende verhoudingstabel maken, waarmee we uitrekenen hoeveel gram waterstofgas en hoeveel gram chloorgas er vrijkomt bij de ontleding van 50,0 gram waterstofchloride (zoals gevraagd is):
We kunnen nog even checken of we dit goed hebben uitgerekend, door de 1,4 gram waterstofgas en de 48,6 gram chloorgas bij elkaar op te tellen. We vinden dan inderdaad 1,4 + 48,6 = 50,0 gram. Dit klopt!
|
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: Een leerling verbrandt 16,5 gram magnesium. Bereken hoeveel gram zuurstof we hiervoor nodig hebben. En bereken hoeveel magnesiumoxide hierbij ontstaat. Antwoord: Bij deze reactie ontstaat magnesiumoxide. Dit is een zout. Een magnesiumion heeft lading 2+ en een zuurstofion heeft lading 2-. De verhoudingsformule wordt hiermee: MgO. Een eerste poging tot een reactievergelijking wordt hiermee: $$ \text{... Mg} + \text{... O}_2 \rightarrow \text{... MgO}$$Deze vergelijking maken we als volgt kloppend: $$ \text{2 Mg} + \text{O}_2 \rightarrow \text{2 MgO}$$Nu we de reactie hebben kunnen we de massaverhouding berekenen van het magnesium en de zuurstof bij de reactie. In het periodiek systeem lezen we dat een zuurstofion een massa hefet van 16,0 u is en een magnesiumion een massa van 24,3 u. Van beide stoffen doen twee atomen mee in de bovenstaande reactie. Dit levert een massa van 2 × 16,0 = 32,0 u voor zuurstof en 2 × 24,3 = 48,6 u voor magnesium. De massaverhouding tussen zuurstof en magnesium wordt hiermee: $$ 32,0 : 48,6 $$In de vraag lezen we dat 16,5 gram magnesium reageert. Met een verhoudingstabel berekenen we hiermee hoeveel zuurstof hiermee reageert:
Er heeft dus 10,9 gram zuurstof gereageerd. Er werd ook gevraag hoeveel gram magnesiumoxide er is ontstaan. Dit kunnen we vinden met behulp van de wet van behoud van massa. Als 16,5 gram magnesium en 10,9 gram zuurstof met elkaar reageren, dan ontstaat er 16,5 + 10,9 = 27,4 gram magnesiumoxide.
|
 Voorbeeld
Voorbeeld
|
|
Vraag: Als magnesium (Mg) met fosfor (P4) reageert, ontstaat het zout magnesiumfosfide. Vind de reactievergelijking en bepaal daarna de massaverhouding waarin magnesium en fosfor met elkaar reageren. Antwoord: Eerst willen we de verhoudingsformule van het zout (magnesiumfosfide) te weten komen. We beginnen met het opschrijven van de ionen waaruit dit zout bestaat: $$ \mathrm{Mg}^{2+} \;\;\;\; \mathrm{P}^{3-} $$Omdat een zout neutraal moet zijn, moeten de ionen in de volgende verhouding voorkomen: $$ \mathrm{Mg}^{2+} \;\; \mathrm{Mg}^{2+} \;\; \mathrm{Mg}^{2+} \;\;\;\; \mathrm{P}^{3-} \;\; \mathrm{P}^{3-}$$De verhoudingsformule wordt dus: $$ \mathrm{Mg}_3\mathrm{P}_2 $$De eerste poging tot het maken van een reactievergelijking wordt hiermee: $$ \mathrm{... Mg} + \mathrm{... P}_4 \rightarrow \mathrm{... Mg}_3\mathrm{P}_2 $$Nu maken we de reactievergelijking kloppend: $$ 6 \mathrm{Mg} + \mathrm{P}_4 \rightarrow 2 \mathrm{Mg}_3\mathrm{P}_2 $$In het periodiek systeem vinden we dat een magnesiumatoom een massa heeft van 24,3 u en een fosforatoom een massa van 31,0 u. Er reageren 6 magnesiumatomen. De totale massa hiervan is 24,3 × 6 = 145,8 u. Er reageren 4 fosforatomen. De totale massa hiervan is 31,0 × 4 = 124 u. We hebben hiermee gevonden dat magnesium en fosfor in de volgende massaverhouding met elkaar reageren bij de vorming van magnesiumfosfide: $$ 145,8 : 124 $$
|
Open het periodiek systeem in een nieuwe tab.
Leerdoelen:
| ||||
| ||||
Leerdoelen:
| ||||
|
§3 Overmaat
In veel gevallen is er bij een reactie te veel van één van de stoffen aanwezig, waardoor niet alles kan reageren en dus een deel van de beginstoffen overblijft. We spreken dan van een overmaat. In deze paragraaf gaan we hier mee rekenen.
Stel we laten 25,0 gram magnesium en 25,0 gram zuurstof met elkaar reageren. Hoeveel gram magnesiumoxide ontstaat er dan? In de vorige paragraaf hebben we gezien dat zuurstof en magnesium reageren met massaverhouding 32,0 : 48,6. Hiermee kunnen we bijvoorbeeld uitrekenen hoeveel gram magnesium we kunnen laten reageren met 25,0 gram zuurstof.
| Zuurstof | 32,0 gram | 25,0 gram |
| Magnesium | 48,6 gram | 38,0 gram |
Als we 25,0 gram zuurstof willen laten reageren, dan hebben we dus wel 38,0 gram magnesium nodig. Maar we hebben slechts 25,0 gram magnesium, dus deze informatie is niet bruikbaar. Laten we in plaats daarvan eens uitrekenen hoeveel gram zuurstof er nodig is om 25,0 gram magnesium te laten reageren:
| Zuurstof | 32,0 gram | 16,5 gram |
| Magnesium | 48,6 gram | 25,0 gram |
Er is dus slechts 16,5 gram zuurstof nodig om 25,0 gram magnesium te laten reageren. Maar we begonnen met 25,0 gram zuurstof. Dit betekent dat als alle magnesium gereageerd heeft, er nog steeds 25,0 - 16,5 = 8,5 gram zuurstof over is. We zeggen dan dat de zuurstof in overmaat aanwezig is.
Met behulp van de wet van behoud van massa kunnen we ook uitrekenen dat er 25,0 + 16,7 = 41,7 gram magnesiumoxide is ontstaan bij de reactie. We vatten de reactie als volgt samen:
$$ \textbf{25,0 } \mathrm{g\;magnesium} + \textbf{25,0 } \mathrm{g\;zuurstof} \rightarrow \textbf{41,7 } \mathrm{g\;magnesiumoxide} + \textbf{8,3 } \mathrm{g\;zuurstof} $$Merk op dat de massa van de stoffen aan beide kanten van de vergelijking in totaal 50,0 gram is. Dit is in overeenstemming met de wet van behoud van massa.
Leerdoelen:
| ||
|

Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
|
Samengestelde ionen |
|
|
carbonaat-ion |
CO32- |
|
nitraat-ion |
NO3- |
|
sulfaat-ion |
SO42- |
|
fosfaat-ion |
PO43- |
|
hydroxide-ion |
OH- |
|
Ammonium-ion |
NH4+ |
|
Zouten |
||
|
Keukenzout |
Natriumchloride |
NaCl |
|
Kalkwater |
Calciumhydroxide |
Ca(OH)2 (aq) |
|
Kalksteen |
Calciumcarbonaat |
CaCO3 |
|
Soda |
Natriumcarbonaat |
Na2CO3 |
|
Natronloog |
Natriumhydroxide |
NaOH (aq) |
|
Zuren |
Basen |
||
|
Triviale naam |
Formule |
Triviale naam |
Formule |
|
Zoutzuur |
HCl (aq) |
Natronloog |
NaOH (aq) |
|
Salpeterzuur |
HNO3 |
Kalkwater |
Ca(OH)2 (aq) |
|
Zwavelzuur |
H2SO4 |
Soda |
Na2CO3 |
|
Koolzuurhoudend water |
H2CO3 (aq) |
Ammonia |
NH3 (aq) |
|
Azijnzuur |
HAc |
|
|
|
Fosforzuur |
H3PO4 |
|
|
|
Zuur-ionen |
Base-ionen |
|
H+ |
OH- |
|
|
O2- |
|
|
CO32- |
|
|
NH3 |
| BINAS: | |
| 33 | Elementen, symbolen, atoomnummers en atoommassa's |
| 34 | Periodiek systeem |
| 36 | Zuur-base-indicatoren |
| 42 | Triviale en rationele namen stoffen |