Hoofdstuk 4
Atomen en Moleculen
§1 Het periodiek systeem §2 Metalen §3 Moleculaire stoffen §4 Naamgeving §5 Koolwaterstoffen §6 Het milieu
§1 Het periodiek systeem
In dit hoofdstuk gaan we kijken naar de verschillende stoffen waar de wereld uit bestaat. Het blijkt dat de wereld bestaat uit 118 verschillende atomen. Deze atomen kunnen gecombineerd worden tot zogenaamde metaalroosters, moleculen en zouten. Metaalroosters en moleculen bespreken we in dit hoofdstuk en zouten in het volgende hoofdstuk. In deze paragraaf beginnen we met het bestuderen van atomen.
De wereld bestaat uit miljoenen soorten stoffen, maar al deze stoffen blijken te bestaan uit een combinatie van slechts 118 soorten kleine bolvormige deeltjes die we atomen noemen. Elk van de 118 atoomsoorten heeft een naam en een symbool. Dit symbool bestaat uit een hoofdletter en in sommige gevallen ook een kleine letter (zie de onderstaande afbeelding). Een stof die uit slechts één soort atomen bestaat noemen we een element.
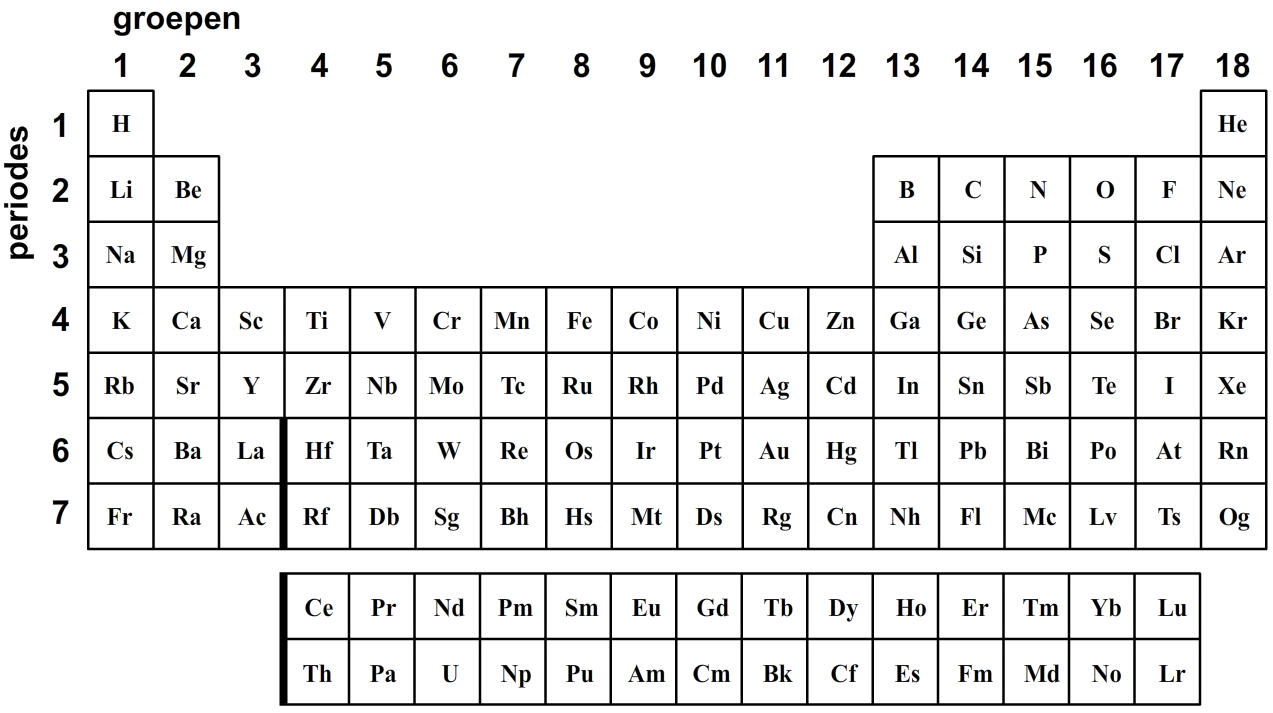
In de 19de eeuw zijn door de wetenschapper Dmitri Mendelejev de atoomsoorten op rij gezet van de lichtste tot de zwaarste. Hij ontdekte toen dat de eigenschappen van de stoffen zich in een vast patroon herhaalden. Bijvoorbeeld, atoom nummer 2 is niet reactief, atoom nummer 3 juist wel en 4 iets minder. Dit herhaalde zich bij atoom 10 (niet reactief), atoom 11 (reactief) en atoom 12 (iets minder reactief). Mendelejev kwam toen op het briljante idee om de stoffen met gelijke eigenschappen onder elkaar te noteren. Het resultaat is de bovenstaande tabel, genaamd het periodiek systeem der elementen.
We lezen dit systeem van links naar rechts en dan rij voor rij naar beneden. De (horizontale) rijen worden ook we periodes genoemd en de (verticale) kolommen worden groepen genoemd. Deze groepen en kolommen zijn hierboven genummerd. Je kan een soortgelijke tabel in BINAS vinden.
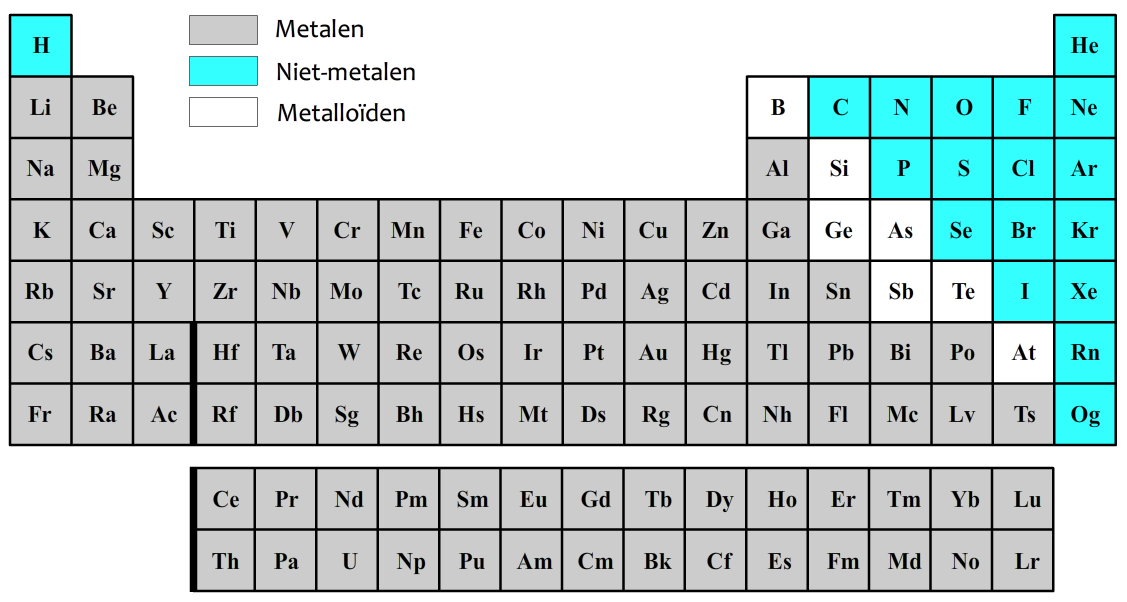
De atomen kunnen in drie groepen worden verdeeld. De atoomsoorten die hieronder in grijs zijn weergegeven noemen we metalen. De atoomsoorten die blauw zijn weergegeven noemen we niet-metalen. De atomen in de witte vlakjes worden metalloïden genoemd en zitten qua eigenschappen tussen metalen en niet-metalen in.
De volgende atoomsoorten en de bijbehorende symbolen moet je uit je hoofd kennen:
| Metaalatomen | Niet-metaalatomen | ||
| Natrium | Na | Waterstof | H |
| Kalium | K | Koolstof | C |
| Magnesium | Mg | Stikstof | N |
| Calcium | Ca | Fosfor | P |
| Barium | Ba | Zuurstof | O |
| Chroom | Cr | Zwavel | S |
| IJzer | Fe | Fluor | F |
| Nikkel | Ni | Chloor | Cl |
| Platinum | Pt | Broom | Br |
| Koper | Cu | Jood | I |
| Zilver | Ag | Helium | He |
| Goud | Au | Neon | Ne |
| Zink | Zn | Argon | Ar |
| Cadmium | Cd | ||
| Kwik | Hg | ||
| Aluminium | Al | ||
| Tin | Sn | Metalloïde | |
| Lood | Pb | Silicium | Si |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Metalen
In deze paragraaf bestuderen we een aantal eigenschappen van metalen.
Metalen zijn te herkennen aan de volgende stofeigenschappen:
- Ze glimmen als ze gepolijst zijn
- Ze zijn buigbaar
- Ze zijn goede geleiders van warmte en elektriciteit
- Ze zijn vast bij kamertemperatuur, met uitzondering van kwik. Dit is vloeibaar bij kamertemperatuur (zie de linker onderstaande afbeelding)
- De meeste metalen zijn grijs, maar ook hier zijn een paar uitzonderingen. Goud is bijvoorbeeld geel en koper is oranje (zie de rechter afbeelding).
 (Afbeelding: images-of-elements.com; CC BY-SA 3.0; Marmall4; CC BY 3.0)
(Afbeelding: images-of-elements.com; CC BY-SA 3.0; Marmall4; CC BY 3.0)
Je kunt kwik tegenwoordig niet meer kopen, omdat het erg giftig is. We moeten het daarom dus even doen met het volgende filmpje:
 EXPERIMENT
EXPERIMENT
|
| In deze filmpjes zien we het vloeibare metaal kwik. |
In de onderstaande afbeelding zijn de metalen in het periodiek systeem in het grijs aangegeven.
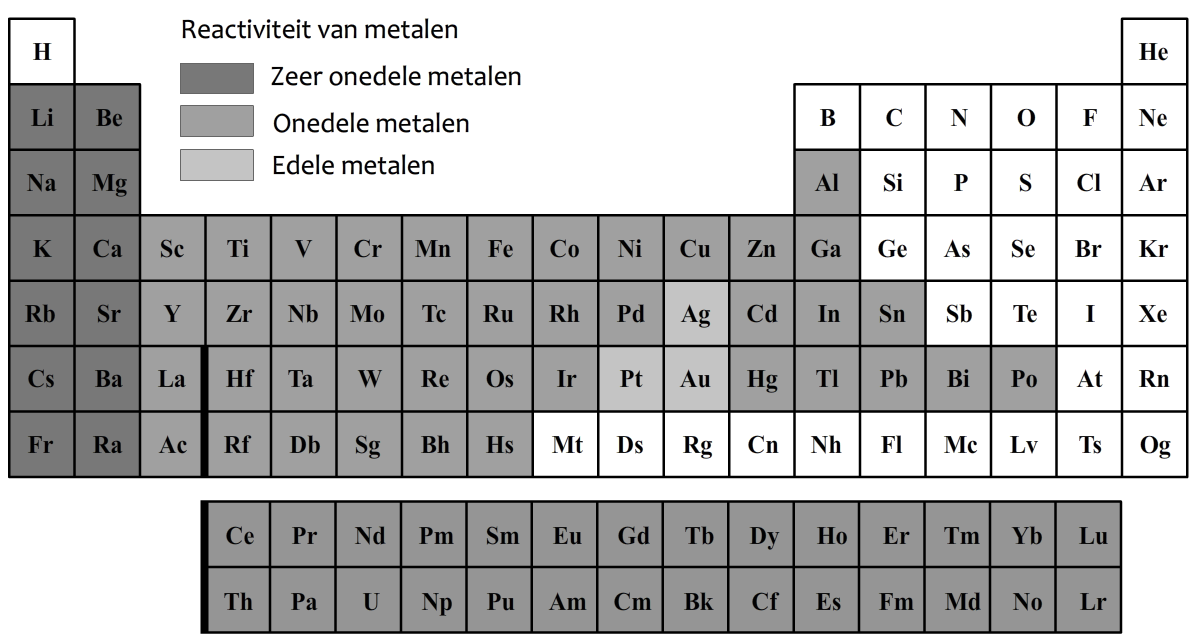
De metalen in de eerste linker twee kolommen van het periodiek systeem worden de zeer onedele metalen genoemd. Deze metalen zijn extreem reactief. De stoffen in de eerste kolom reageren bijvoorbeeld heftig met water en zuurstof. Een voorbeeld is het metaal natrium. In de linker onderstaande afbeelding zien we een explosie die ontstaat als je natrium in water gooit.
De metalen in de tweede kolom reageren iets minder heftig. Deze metalen reageren heftig met zuurstof als ze eerst worden verhit. Rechtsonder zien we bijvoorbeeld een foto van de verbranding van magnesium. Deze chemische reactie zorgt voor een fel wit licht.


 EXPERIMENT
EXPERIMENT
|
| In deze filmpjes zie je de heftige reactie tussen natrium en water. |
 EXPERIMENT
EXPERIMENT
| ||
|
De stoffen zilver (Ag), goud (Au) en platina (Pt) worden edele metalen genoemd. Deze metalen reageren niet of nauwelijks met andere stoffen.
 (Afbeelding: Alchemist-hp; CC BY-SA 3.0 / Alchemist-hp; CC BY-SA 3.0 / Robert Lavinsky; CC BY 3.0)
(Afbeelding: Alchemist-hp; CC BY-SA 3.0 / Alchemist-hp; CC BY-SA 3.0 / Robert Lavinsky; CC BY 3.0)
De overige metalen noemen we de onedele metalen. Deze metalen reageren ook met zuurstof, maar deze reacties verlopen erg langzaam. We noemen de reactie tussen metalen en zuurstof ook wel oxidatie of corrosie. Alleen bij het oxideren van ijzer spreken we ook wel van roesten. Dankzij oxidatie komen we zowel zeer onedele als onedele metalen zo goed als nooit in elementaire vorm tegen in de natuur. Na verloop van tijd zijn al deze metalen immers allemaal geoxideerd.
Een nadeel van de corrosie van ijzer is dat roest erg broos is en zuurstof daardoor gemakkelijk bij het ijzer komt onder de roestlaag, waardoor het verder blijft roesten (zie de linker onderstaande afbeelding). Er zijn ook metalen die meer corrosiebestendig zijn. Dit komt doordat ze een dun en hard oxidelaagje vormen dat het metaal eronder beschermd tegen verdere corrosie. Bij het oxideren van koper ontstaat koperoxide, ook wel patina genoemd. Patina is lichtgroen. Het Vrijheidsbeeld is hier bijvoorbeeld van gemaakt (zie de middelste afbeelding). Bij chroom ontstaat een dun doorzichtig laagje chroomoxide. Doordat dit laagje doorzichtig is, blijft het glimmende metaal eronder goed zichtbaar. Dit is de reden dat bijvoorbeeld ijzeren kranen vaak met een laagje chroom worden bedekt (zie de rechter afbeelding). Dit wordt verchromen genoemd. Een andere manier om ijzer te beschermen tegen corrosie is door het te bedekken met een laagje zink. Dit wordt galvaniseren genoemd. Je kan het ijzer natuurlijk ook gewoon verven.


 (Afbeelding: Dudva; CC BY-SA 4.0 / Matthew Bowden; www.digitallyrefreshing.com; PD )
(Afbeelding: Dudva; CC BY-SA 4.0 / Matthew Bowden; www.digitallyrefreshing.com; PD )
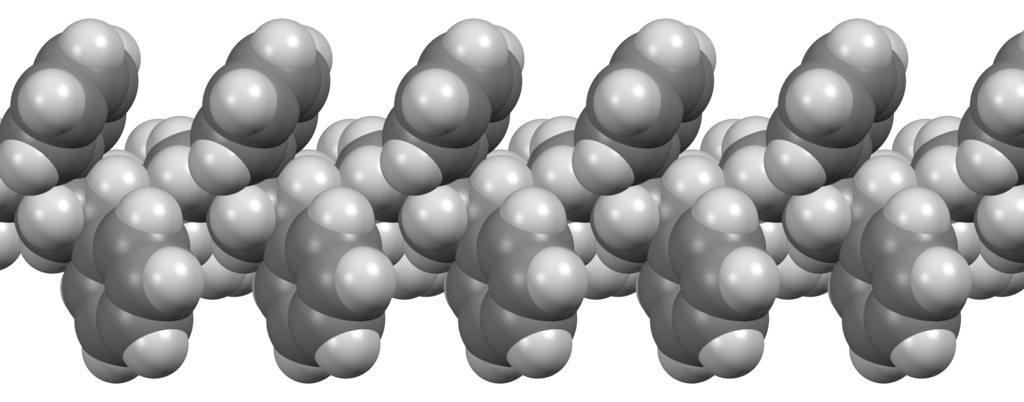
Als we metaalatomen samenbrengen in vaste vorm, dan ordenen ze zich meestal in een regelmatig patroon dat een metaalrooster wordt genoemd (zie de onderstaande afbeelding).

Een zuiver metaal bestaat slechts uit één atoomsoort en als gevolg passen de atomen netjes naast elkaar in het metaalrooster. Het gevolg hiervan is dat de atomen in deze roosters gemakkelijk langs elkaar kunnen worden geschoven (zie de linker onderstaande afbeelding). Zuivere metalen zijn hierdoor buigbaar. Een mengsel van een metaal en een andere stof noemen we een legering. Doordat verschillende soorten atomen verschillende groottes hebben, verbreekt de legering de perfecte ordening van het rooster (zie de middelste twee afbeeldingen). Als gevolg hiervan zijn legeringen een stuk sterker. Een bekend voorbeeld van een legering is staal. Dit bestaat uit ijzer gemengd met een beetje koolstof. Staal wordt bijvoorbeeld gebruikt voor de kabels die een brug omhoog houden (zie de rechter afbeelding).


Een aantal veelvoorkomende legeringen kan je in BINAS vinden. Hier kan je o.a. lezen dat de legering brons een combinatie van koper en tin is, messing een combinatie van koper en zink en soldeer een combinatie van tin en lood.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Moleculaire stoffen
In deze paragraaf bestuderen we een aantal eigenschappen van niet-metalen. Ook gaan we leren dat niet-metalen combineren tot moleculen.
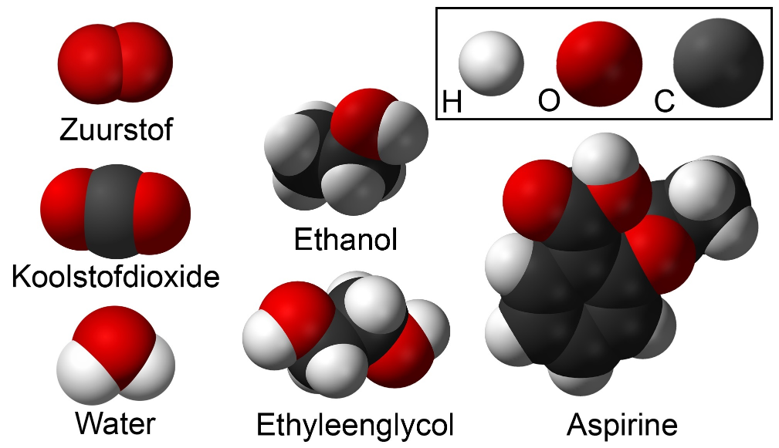
Als we niet-metaalatomen samenbrengen, dan groeperen ze zich meestal in vaste combinaties die we moleculen noemen. In de middelste onderstaande afbeelding zien we bijvoorbeeld twee watermoleculen. Moleculen beschrijven we met behulp van een molecuulformule. De molecuulformule van een watermolecuul is H2O, omdat het uit twee waterstofatomen (H2) en één zuurstofatoom (O) bestaat. De "2" in H2O noemen we een index (meervoud indices).

Het soort molecuul bepaalt met welk soort stof we te maken hebben. Neem bijvoorbeeld de onderste twee moleculen. Links zien we water (H2O) en rechts zien we waterstofperoxide (H2O2). Waterstofperoxide bevat slechts één zuurstofatoom meer dan water, maar toch is het een geheel andere stof. Waterstofperoxide wordt bijvoorbeeld gebruikt voor het blonderen van haar!
 Bron: S. Nova (glas water)
Bron: S. Nova (glas water)
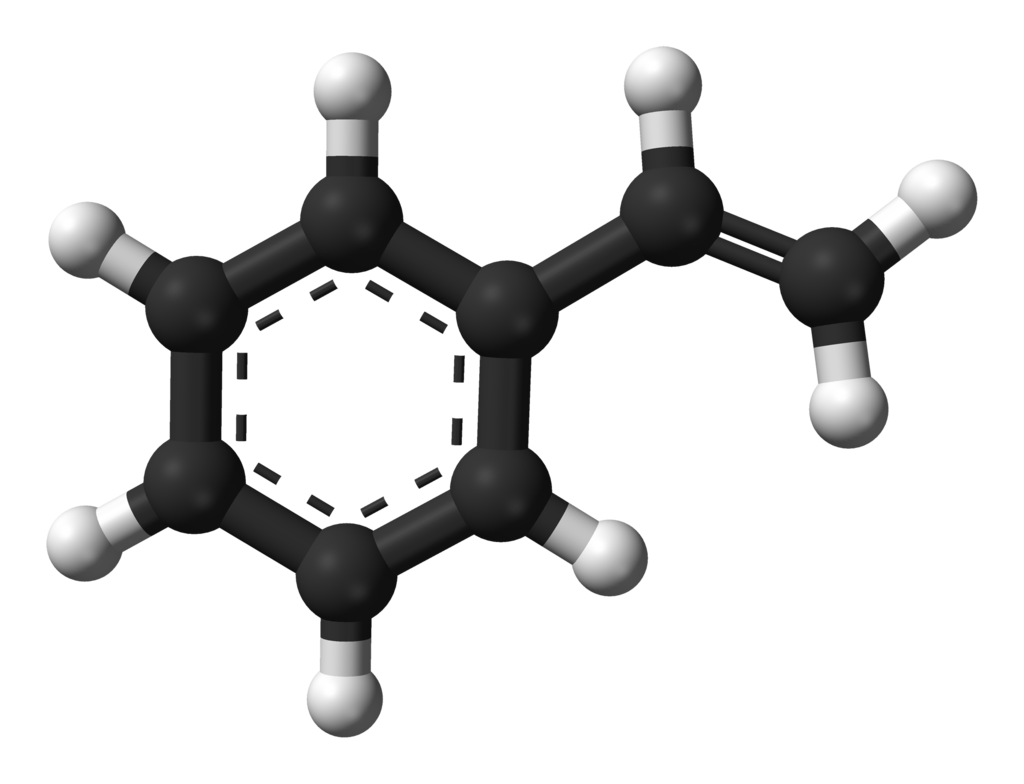
Hieronder zien we een aantal moleculen die we kunnen maken met alleen de atomen waterstof (H), zuurstof (O) en koolstof (C):
Ook de fase van een stof kunnen we weergeven met een molecuulformule. We gebruiken hiervoor de eerste letter van de Engelse woorden "solid" (vaste stof), "liquid" (vloeistof) en "gas" (gas). We schrijven deze letter tussen haakjes achter de molecuulformule (zie de onderstaande afbeelding). We noemen dit ook wel toestandsaanduidingen.

Ook het aantal moleculen kunnen we in de molecuulformule weergeven. Dit doen we door een getal voor de molecuulformule te schrijven. We noemen dit getal de coëfficiënt. In de onderstaande afbeelding zijn bijvoorbeeld 10 watermoleculen in gasfase afgebeeld. Onder de afbeelding zien we de bijbehorende molecuulformule.

In het onderstaande periodiek systeem zijn de niet-metalen in kleur aangegeven.
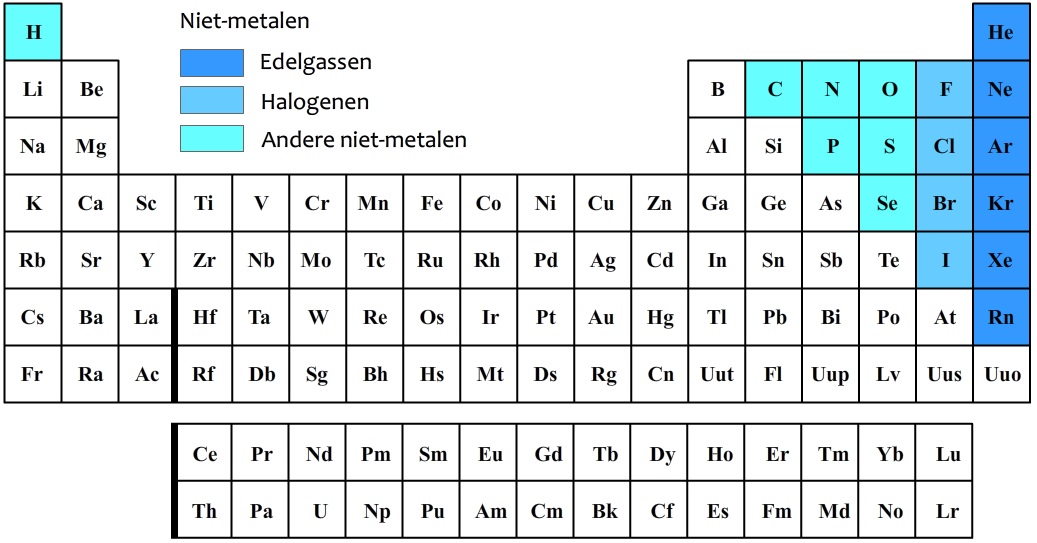
De niet-metalen in de meest rechtse kolom worden de edelgassen genoemd. De bekendste voorbeelden zijn helium (He), neon (Ne) en argon (Ar). Edelgassen zijn niet reactief. Dit betekent dat ze vrijwel nooit met andere stoffen reageren. Edelgassen kunnen wel gebruikt worden voor neonverlichting. Elk van deze gassen licht namelijk op in een andere kleur wanneer er stroom doorheen loopt (zie de onderstaande afbeelding). Omdat helium een erg kleine dichtheid heeft, wordt deze stof ook gebruikt in heliumballonnen en zeppelins.
 (Afbeelding: Pslawinski; CC BY-SA 2.5)
(Afbeelding: Pslawinski; CC BY-SA 2.5)
De atomen van edelgassen bewegen allemaal los van elkaar (zie de onderstaande afbeelding). Edelgassen vormen dus geen moleculen.

De niet-metalen in de tweede kolom van rechts in het periodiek systeem worden de halogenen genoemd. De halogenen zijn juist erg reactief en reageren vooral goed met metalen. De bekendste halogenen zijn fluor (F) en chloor (Cl). Dit zijn beide giftige, lichtgele gassen. Zoals je waarschijnlijk wel weet wordt fluor gebruikt in tandpasta en wordt chloor gebruikt voor het ontsmetten van zwembadwater. Natuurlijk wordt hier niet elementair fluor en elementair chloor bedoeld, want dat is immers giftig!
Als zuivere stof komen de halogenen in paren voor (dus in groepjes van twee). Dit is goed te zien in de onderstaande afbeelding. Een chloormolecuul heeft dus de molecuulformule Cl2 en bestaat uit twee chlooratomen. Een fluormolecuul heeft de molecuulformule F2 en bestaat uit twee fluoratomen. Etc.

Naast de halogenen komen ook stikstofmoleculen (N2), zuurstofmoleculen (O2) en waterstofmoleculen (H2) in paren voor. Het is belangrijk dat je dit uit je hoofd weet. Zuurstof (O2) en stikstof (N2) zijn beide gassen die in grote hoeveelheden in de lucht voorkomen. De lucht bestaat wel voor 78 %vol uit stikstof en voor 21 %vol uit zuurstof (er zit verder nog 0,9 %vol argon en slechts 0,04 vol% koolstofdioxide in de lucht). Waterstof is de atoomsoort met de kleinste massa en als gevolg werd het vroeger gebruikt in zeppelins. Dit bleek echter niet het beste plan, omdat waterstof ook brandbaar is. In de onderstaande beroemde foto zien we de explosie van de Hindenburg Zeppelin.
 (Afbeelding: Sam Shere; PD)
(Afbeelding: Sam Shere; PD)
De laatste niet-metalen die we bespreken zijn koolstof, fosfor en zwavel. Koolstof (C) kan voorkomen als roet, maar ook als grafiet en diamant (zie de onderstaande afbeeldingen). Grafiet is zwart en voelt vettig aan en wordt gebruikt in potloden. Onder zeer hoge druk en bij zeer hoge temperatuur verandert grafiet in diamant. Diamant is een heldere vaste stof die vaak in sieraden wordt gebruikt. Het is de hardste stof die bestaat.


 (Afbeelding: Y.K. Liao; CC BY-SA 4.0 / Dmgerman; CC BY 3.0 / Pixabay; PD)
(Afbeelding: Y.K. Liao; CC BY-SA 4.0 / Dmgerman; CC BY 3.0 / Pixabay; PD)
Zwavel (S) is een vaste gele stof die veel voorkomt in vulkanische gebieden (zie de linker onderstaande afbeelding). Zwavel is brandbaar en wordt bijvoorbeeld gebruikt in de kop van lucifers en in vuurwerk. Van fosfor (P) bestaat zowel een witte als een rode variant (zie de rechter onderstaande afbeeldingen). De witte variant is giftig, brandbaar en erg reactief. Rode fosfor is minder brandbaar en wordt bijvoorbeeld gebruikt op het strijkvlak van luciferdoosjes.
 (Afbeelding: Ben Mills; PD / W. Oelen; CC BY 3.0)
(Afbeelding: Ben Mills; PD / W. Oelen; CC BY 3.0)
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Naamgeving
In deze paragraaf gaan we leren molecuulformules in woorden uit te drukken.
Molecuulformules kunnen we ook in woorden noteren. Voor de indices in de molecuulformules gebruiken we de volgende Griekse voorvoegsels:
| Voorvoegsels | Cijfer |
| mono- | één |
| di- | twee |
| tri- | drie |
| tetra- | vier |
| penta- | vijf |
Daarnaast eindigen we de namen op "-ide". Neem bijvoorbeeld Cl2. Dit spreken we uit als dichloride. En N2F4 spreken we uit als distikstoftetrafluoride. Het voorvoegsel mono- wordt altijd weggelaten bij het eerst genoemde atoom. ClF wordt dus niet "monochloor-monofluoride", maar chloormonofluoride.
Als het laatste atoom zuurstof (O) is, dan eindigen we de benaming niet op "zuurstofide", maar op -oxide. Denk bijvoorbeeld aan koolstofdioxide (CO2). Als het laatste atoom zwavel (S) is, dan eindigen we de benaming niet op "zwavelide", maar op -sulfide. H2S wordt dus diwaterstofmonosulfide, terwijl we SO2 gewoon uitspreken als zwaveldioxide. Op soortgelijke manier noteren we fosfor als fosfide en broom als bromide.
De hierboven besproken naamgeving noemen we de rationele naamgeving. Slechts weinig mensen zullen echter voor water de naam diwaterstofmono-oxide gebruiken. In plaats daarvan gebruiken we gewoon de naam "water". Dit noemen we de triviale naam van de stof. Hieronder vind je een aantal triviale namen die je uit het hoofd moet weten:
| Triviale naam | Chemische formule |
| Water | H2O |
| Waterstofperoxide | H2O2 |
| Ammoniak | NH3 |
| Alcohol | C6H12O |
| Glucose | C6H12O6 |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Koolwaterstoffen
In deze paragraaf bestuderen we moleculen genaamd koolwaterstoffen. Dit zijn stoffen die uit koolstof en waterstof bestaan.
Moleculen die uit koolstof- en waterstofatomen bestaan noemen we koolwaterstoffen. Voor koolwaterstoffen gebruiken we een aparte naamgeving. Hieronder zien we de acht simpelste koolwaterstoffen. Methaan, ethaan, propaan en butaan zijn brandbare gassen. Methaan wordt in het dagelijks leven ook wel aardgas genoemd. Als we de gassen propaan en butaan genoeg onder druk zetten, dan worden deze gassen vloeibaar. In vloeibare vorm kunnen ze gemakkelijker vervoerd worden. We noemen dit LPG. Pentaan, hexaan, heptaan en octaan zijn bij kamertemperatuur vloeibare brandstoffen. Behalve methaan is het niet nodig deze stoffen en molecuulformules uit je hoofd te kennen.

Als het aantal koolstofatomen in de keten toeneemt, dan vinden we op een gegeven moment benzine en diesel (veelgebruikte brandstoffen voor auto's), kerosine (een brandstof voor vliegtuigen), stookolie (voor schepen) en uiteindelijk ook kaarsvet, verschillende cosmetica waaronder vaseline, bepaalde medicijnen, kunststof en zelfs asfalt. In de laatste twee gevallen bestaan de ketens uit wel duizenden koolstofatomen.
Deze stoffen kunnen allemaal worden gewonnen uit een fossiele brandstof genaamd ruwe aardolie. Ruwe aardolie is een mengsel van duizenden verschillende koolwaterstoffen. In een olieraffinaderij worden deze stoffen met behulp van destillatie opgesplitst in verschillende fracties. Er wordt hiervoor een destillatietoren gebruikt (zie de onderstaande afbeelding).
De temperatuur in de destillatietoren neemt af met de hoogte en zo kunnen op verschillende hoogten verschillende moleculen worden verzameld en afgetapt. Zoals je kan zien zijn de lichtste moleculen aardgas en de zwaarste moleculen zijn asfalt.
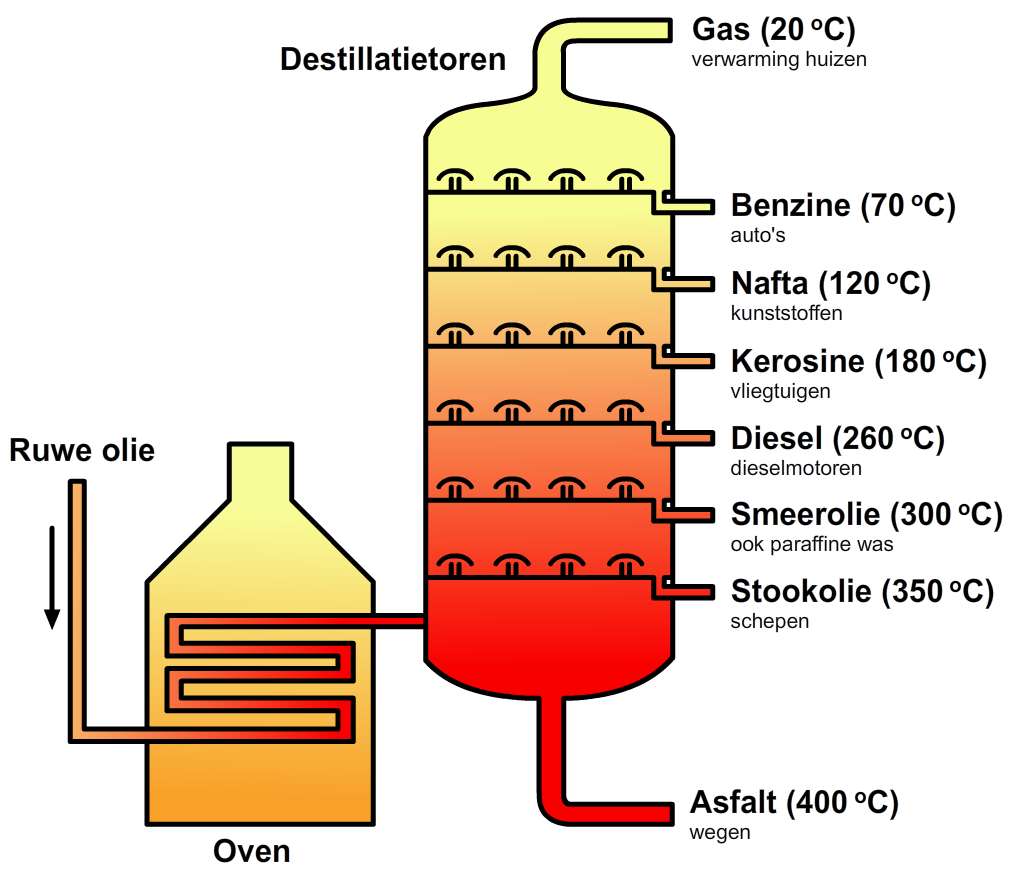
Met behulp van kraken kunnen langere koolwaterstoffen worden opgesplitst in kleinere stukjes. Zo kan je bijvoorbeeld benzine maken van stookolie.
In de destillatietoren zien we ook de stof nafta. Hiermee kunnen kunststoffen worden vervaardigd (in het dagelijks leven ook wel plastics genoemd). De nafta wordt eerst met behulp van kraken opgedeeld in kleine moleculen die we monomeren noemen. Deze monomeren kunnen dan aan elkaar gekoppeld worden tot een keten van duizenden koolstofatomen (zie de onderstaande afbeelding). De gevormde ketens noemen we polymeren en het maken van polymeren noemen we polymerisatie.

Er bestaan veel verschillende soorten kunststoffen. Denk bijvoorbeeld aan polyetheen (voor o.a. plastic tassen), PVC, oftewel polyvinylchloride (voor o.a. plastic buizen), PET, oftewel Polyethyleentereftalaat (voor o.a. frisdrankflessen), en piepschuim, oftewel polystyreen (voor o.a. isolatiemateriaal). Het is niet nodig de namen van deze kunststoffen uit je hoofd te kennen. Merk wel op dat al deze stoffen het voorvoegsel "poly" bevatten. Dit betekent "veel" en wordt gebruikt omdat kunststoffen polymeren zijn die uit een keten van heel veel monomeren bestaan.
Kunststoffen worden soms onderverdeeld in thermoharders en thermoplasten. Thermoplasten worden zacht als ze verwarmd worden. Als gevolg zijn deze kunststoffen gemakkelijk in een andere vorm te gieten of te persen. Ook zijn deze plastics gemakkelijk te recyclen. Thermoharders, daarentegen, zijn moeilijk te vervormen en daardoor lastiger te recyclen.
Een groot voordeel van kunststoffen is dat ze goedkoop te produceren zijn en nauwelijks worden aangetast door lucht en water (wat wel het geval is bij bijvoorbeeld ijzer en hout). Ook zijn kunststoffen slechte geleiders van elektrische stroom en warmte, waardoor het ook geschikte materialen zijn voor isolatie. De nadelen van kunststoffen zijn met name voor het milieu. Het duurt jaren voordat kunststoffen in de natuur afbreken en bij de verbranding ervan kunnen giftige stoffen vrijkomen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§6 Het milieu
Met fossiele brandstoffen kunnen we o.a. energie opwekken. Dit heeft natuurlijk veel voordelen, maar heeft ook negatieve effecten op het milieu. Dit is het onderwerp van deze paragraaf.
Veel van de energie die we in huishoudens, in het verkeer en in de industrie gebruiken komt van fossiele brandstoffen, zoals aardolie, aardgas en steenkool. Aardolie, zoals we hebben gelezen, wordt in de vorm van benzine en diesel veel gebruikt in auto's, in de vorm van kerosine in vliegtuigen en als stookolie in schepen. Aardgas wordt veel gebruikt voor het verwarmen van huizen of het opwekken van elektriciteit. Steenkool wordt ook gebruikt voor het opwekken van elektriciteit, maar dit gebeurt tegenwoordig steeds minder, omdat deze brandstof erg vervuilend is.
Het nadeel van alle fossiele brandstoffen (met name steenkool), is dat bij de verbranding hiervan veel koolstofdioxide (CO2) vrijkomt. Koolstofdioxide heeft veel positieve eigenschappen. Het is bijvoorbeeld een voedingstof voor planten en zonder CO2 in de atmosfeer zou het op aarde gemiddeld 30 graden Celsius kouder zijn. Maar in de laatste 200 jaar heeft de mensheid door industrialisatie zoveel CO2 in de atmosfeer vrijgelaten dat de gemiddelde temperatuur van de aarde steeds verder is gaan toenemen. We noemen dit het broeikaseffect. Als gevolg van deze temperatuurstijging smelt het ijs op de Noord- en Zuidpool. Het smelten van landijs zorgt op zijn beurt weer voor een stijging van de zeespiegel. En een snelle stijging van de temperatuur zal ook het weer op veel plekken doen veranderen, waar mens en dier zich op moeten aanpassen.
Bij het verbranden van fossiele brandstoffen komt met name koolstofdioxide en water vrij, maar ook een kleine hoeveelheid schadelijke stoffen. Zo zit er bijvoorbeeld vaak zwavel in ruwe aardolie, die bij de verbranding vrijkomt in de vorm van zwaveldioxide (SO2). Andere ongewenste stoffen die bij verbranding van fossiele brandstoffen vrijkomen zijn stikstofoxiden, zoals NO en NO2. We vatten deze stoffen vaak samen als NOx. Deze stoffen zijn niet in ruwe aardolie aanwezig, maar ontstaan doordat bij de verbranding ervan de temperatuur hoog genoeg wordt dat zuurstof en stikstof uit de lucht met elkaar reageren tot deze stoffen.
Zwaveldioxide (SO2) vormt in reactie met zuurstof en water zwavelzuur en stikstofoxiden (NOx) vormen in reactie met zuurstof en water salpeterzuur. Deze stoffen zorgen voor zure regen. Dit is slecht voor de natuur en kan ook bepaalde steensoorten aantasten, waaronder kalksteen (zie de onderstaande linker afbeelding). Daarnaast zorgen deze en andere stoffen ook nog voor de smog die boven vervuilde steden hangt (zie de rechter afbeelding). Smog kan o.a. zorgen voor irritatie van de slijmvliezen (de binnenkant van je neus en mond), de ogen en de luchtwegen.

 (Afbeelding: Nino Barbieri; CC BY 2.5 / Radek Kolakowski; CC BY 2.0)
(Afbeelding: Nino Barbieri; CC BY 2.5 / Radek Kolakowski; CC BY 2.0)
De hoeveelheid SO2 die vrijkomt bij de verbranding van fossiele brandstoffen kan worden teruggedrongen door zoveel mogelijk de zwavel van tevoren uit de aardolie te verwijderen. NOx is lastiger te verwijderen, omdat het pas bij de verbranding van de fossiele brandstoffen ontstaat. Met behulp van een zogenaamde katalysator (meer hierover in een later hoofdstuk), kan een deel van de stikstofoxiden wel weer worden omgezet in zuurstof en stikstof.
Door de nadelen van fossiele brandstoffen zijn wetenschappers de laatste decennia bezig om fossiele brandstoffen te vervangen door duurzame energiebronnen. Deze energiebronnen zijn schoon, waarmee we bedoelen dat ze geen stoffen uitscheiden die schadelijk zijn voor het milieu. Hier zijn al grote stappen in gezet. Voorbeelden van schone energiebronnen zijn waterkrachtcentrales, windmolens, zonnecellen en kerncentrales.
Andere belangrijke vervuilende stoffen zijn chloorfluorkoolstofverbindingen, meestal bekend als cfk's. Deze stoffen kwamen vroeger veel voor in bijvoorbeeld koelmiddel en als drijfgas voor spuitbussen. Deze stoffen tasten de ozonlaag aan. Dit is een laag van ozon (O3) hoog in de atmosfeer. Ozon is belangrijk omdat het een deel van de UV-straling van de zon tegenhoudt. Deze straling is bij veel blootstelling slecht voor onze huid.
Als laatste noemen we ammoniak (NH3). Deze stof komt voor in o.a. mest dat gebruikt wordt om gewassen beter te laten groeien. Bacteriën zetten deze stof o.a. om in salpeterzuur en hierdoor wordt de bodem zuur. Ook dit is in grote hoeveelheden schadelijk voor de natuur.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
| BINAS: | |
| 33 | Elementen en symbolen |
| 34 | Periodiek systeem |
| 41 | Olieraffinaderij |
| 42 | Triviale en rationele namen stoffen |