Hoofdstuk 6
Warmte
§1 Temperatuur §2 Faseovergangen §3 Warmte §3 Warmtetransport §4 Verwarmen
§1 Temperatuur
In dit hoofdstuk gaan we de wereld om ons heen verklaren aan de hand van de beweging van de kleine deeltjes waaruit de wereld bestaat. In deze eerste paragraaf gaan we de temperatuur op deze manier bestuderen.
Zoals je waarschijnlijk wel weet vertelt de temperatuur ons hoe warm of hoe koud een materiaal is. We meten de temperatuur met een thermometer. Een veelgebruikte thermometer bestaat uit een dun buisje met daarin gekleurde alcohol (zie de onderstaande afbeelding). Als de alcohol warmer wordt, dan zet het uit, waardoor de thermometer een hogere temperatuur aangeeft. Als de alcohol afkoelt, dan krimpt het weer, waardoor het een lagere temperatuur aangeeft.

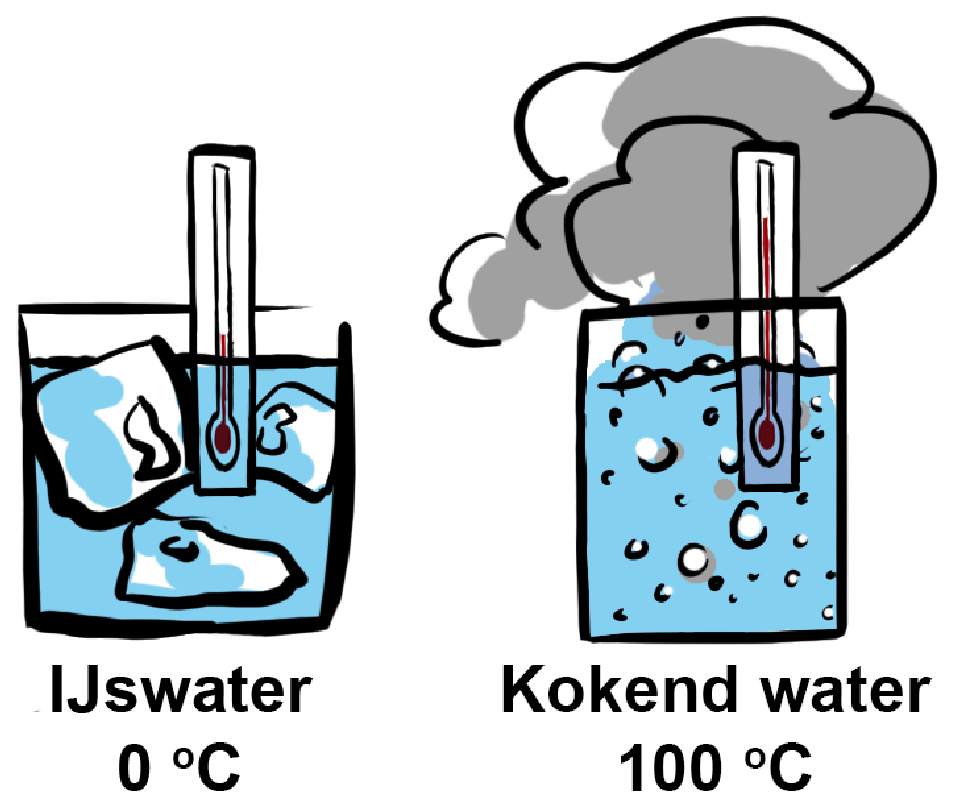
De bekendste eenheid voor de temperatuur is de graden Celsius (°C). Het aanbrengen van een schaalverdeling in graden Celsius wordt ook wel het ijken van een thermometer genoemd. Dit werkt als volgt. Als je een thermometer in ijswater plaatst, dan is de waarde die de thermometer aangeeft gelijk aan 0 °C. Als je de thermometer in kokend water plaatst, dan is de waarde die de thermometer aangeeft gelijk aan 100 °C (zie de onderstaande afbeelding). De afstand tussen deze twee waarden wordt dan in honderd gelijke stapjes van 1 °C verdeeld.
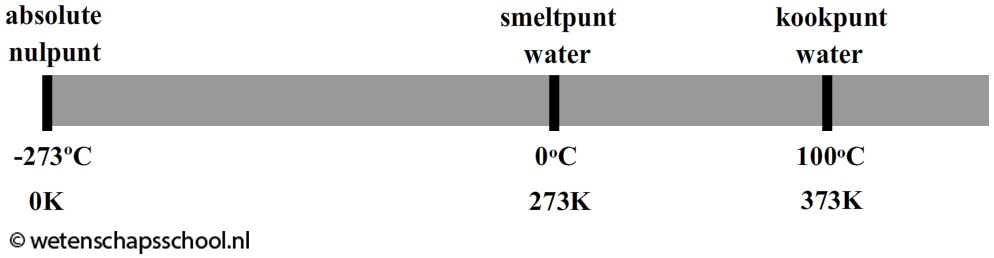
Maar wat is temperatuur eigenlijk? Temperatuur wordt veroorzaakt door de beweging van de deeltjes waaruit stoffen bestaan. Hoe sneller de deeltjes bewegen, hoe hoger de temperatuur van het materiaal. Andersom geldt ook dat hoe langzamer de deeltjes bewegen, hoe lager de temperatuur wordt. Als we een voorwerp blijven afkoelen, dan komt er een moment dat alle atomen stil staan. Dit gebeurt bij -273 °C. Op dat moment is de allerlaagste temperatuur bereikt. We noemen deze temperatuur het absolute nulpunt. Het is niet mogelijk dat een materiaal nog kouder wordt, want de deeltjes staan bij deze temperatuur immers al helemaal stil.
 Demonstratievideo
Demonstratievideo
| ||
|
Sinds de ontdekking van het absolute nulpunt gebruiken we ook vaak de eenheid kelvin (K) voor de temperatuur. Het absolute nulpunt is bij deze schaal gelijkgesteld aan 0 K. Er geldt dus:
|
|
Als voorbeeld zien we in de onderstaande afbeelding het smeltpunt en het kookpunt van water. Water smelt bij 0 oC. Volgens de bovenstaande regel komt dit overeen met 0 oC + 273 = 273 K. Het kookpunt van water is 100 oC. Dit komt overeen met 100 oC + 273 = 373 K.
We kunnen nu ook meteen begrijpen waarom stoffen uitzetten als we de temperatuur verhogen en krimpen als we de temperatuur verlagen. Als we de temperatuur van bijvoorbeeld een stuk metaal verhogen, dan gaan de deeltjes in dit metaal sneller trillen. Door dit trillen duwt elk deeltje de omliggende deeltjes een beetje weg. Het materiaal neemt op deze manier meer ruimte in (zie de onderstaande animatie).
In veel praktische situaties moeten we rekening houden met deze uitzetting. Bij veel bruggen zien we bijvoorbeeld een "ritssluiting" (zie de linker onderstaande afbeelding). Dit geeft de brug ruimte om uit te zetten op een warme dag. In de rechter afbeelding zien we wat er gebeurt als er niet goed wordt nagedacht over de uitzetting van materialen. De rails in de afbeelding zijn helemaal kromgetrokken door het uitzetten.

 (Afbeelding: Matt H. Wade; CC BY-SA 3.0 / PD)
(Afbeelding: Matt H. Wade; CC BY-SA 3.0 / PD)
Bij gassen kan je krimpen en uitzetten nog duidelijker zien. Als je een ballon met daarin lucht koud maakt door het bijvoorbeeld onder te dompelen in vloeibare stikstof, dan zie je de ballon duidelijk krimpen (zie het onderstaande filmpje en de onderstaande afbeeldingen). Als je de ballon daarna weer opwarmt, dan zet de ballon weer uit.

Omdat bij het uitzetten van stoffen de deeltjes verder van elkaar komen te zitten, wordt de dichtheid van de stof hierdoor lager. Later in het hoofdstuk gaan we hier toepassingen van zien.
 Demonstratievideo
Demonstratievideo
|
|
In het onderstaande filmpjes zien we dit effect in de praktijk: |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Faseovergangen
In deze paragraaf gaan we de drie fasen en de faseovergangen begrijpen aan de hand van de beweging van deeltjes.
Stoffen bevinden zich meestal in één van de volgende drie fasen:
- vast
- vloeibaar
- gas
We kennen allemaal de drie fasen van water. Vast water noemen we ijs, vloeibaar water noemen we gewoon "water" en water in gasvorm noemen we waterdamp.
Een stof is vast als de temperatuur onder het smeltpunt ligt. Een stof is vloeibaar als de temperatuur tussen het smeltpunt en het kookpunt ligt en een stof is gasvormig als de temperatuur boven het kookpunt ligt (zie de onderstaande afbeelding).
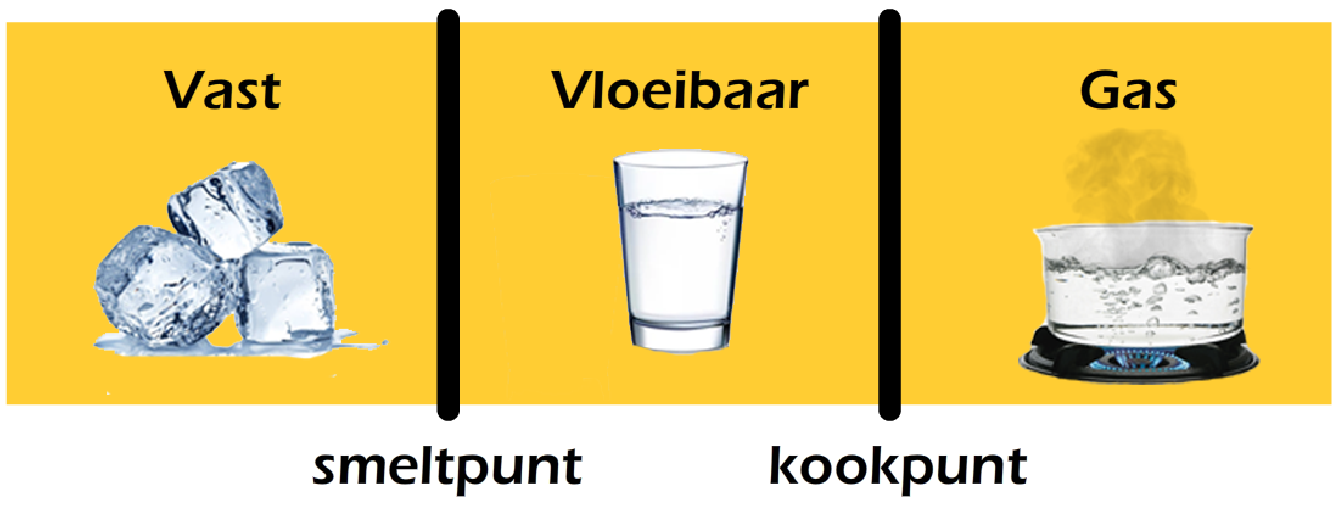
De smelt- en de kookpunten kan je vinden in BINAS. Hieronder zijn de smelt- en de kookpunten van een aantal stoffen weergegeven. In BINAS kan je een uitgebreidere tabel vinden. Zoals je ziet zijn de temperaturen gegeven in kelvin. In de vorige paragraaf heb je geleerd dit om te rekenen naar graden Celsius:
|
Stof |
Smeltpunt (K) |
Kookpunt (k) |
|
Alcohol (ethanol) |
159 |
351 |
|
Benzine |
123 |
- |
|
Ether |
157 |
308 |
|
Kwik |
234 |
630 |
|
Melk |
272 |
373 |
|
Olijfolie |
- |
570 |
|
Petroleum |
203 |
423 |
|
Spiritus |
183 |
351 |
|
Water |
273 |
373 |
|
Zeewater |
270 |
- |
|
Zwavelzuur |
284 |
603 |
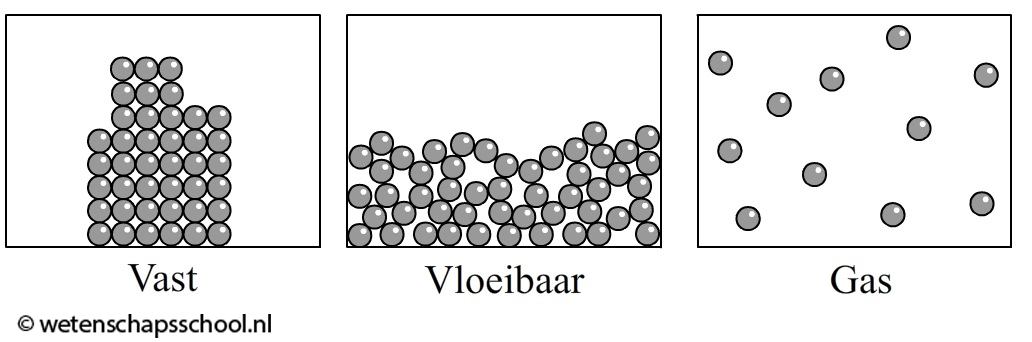
Ook de drie fasen kunnen we met behulp van deeltjes begrijpen. In de onderstaande linker afbeelding is een vaste stof afgebeeld. De deeltjes zitten hier op een vaste plaats en kunnen op deze plaats alleen een beetje heen en weer trillen. Alleen bij 0 K staan de deeltjes helemaal stil.
Bij een vloeistof zitten de deeltjes nog steeds tegen elkaar aan, maar hebben ze geen vaste plek meer. Ze kunnen nu vrij langs elkaar heen bewegen (zie de middelste afbeelding). Dit verklaart de beweeglijkheid van vloeistoffen.
In een gas zijn de deeltjes helemaal los van elkaar en vliegen kriskras door elkaar heen (zie de rechter afbeelding). Een kleurloos gas kan je niet zien. Een voorbeeld hiervan is lucht. De individuele deeltjes zijn immers te klein om met het oog waar te kunnen nemen.
 Demonstratievideo
Demonstratievideo
| ||
|
Als een stof van één fase overgaat naar een andere, dan spreken we van een faseovergang. Een voorbeeld is smelten. Dit is een faseovergang van vast naar vloeibaar. Hieronder zien we links het smelten van ijs. Zelfs een voorwerp zo hard als staal wordt bij hogere temperaturen een vloeistof (zie de middelste afbeelding).
In de rechter afbeelding "zien" we water verdampen. Dit is een overgang van vloeibaar naar gas. Let er hier op dat de nevel die boven het kokende water te zien is, bestaat uit kleine druppels in vloeibare fase. Pas als deze druppels lijken te verdwijnen "in het niets", veranderen ze in een gas (genaamd waterdamp). Dit gas kunnen we niet zien.


 (Afbeelding: Pixabay; PD / P sakthy; CC BY-SA 3.0 / Pixabay; PD-mod)
(Afbeelding: Pixabay; PD / P sakthy; CC BY-SA 3.0 / Pixabay; PD-mod)
Er bestaan zes verschillende faseovergangen. De namen van deze overgangen kan je vinden in de onderstaande afbeelding:
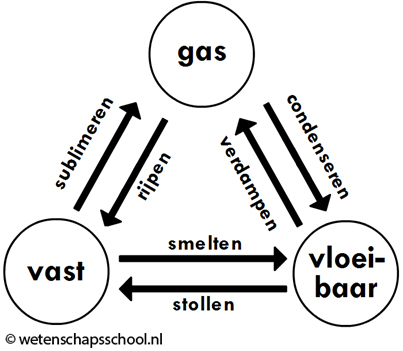
Als een vloeistof in een vaste stof verandert, dan noemen we dit stollen (het stollen van water noemen we ook wel bevriezen). Als een vaste stof in een vloeistof verandert, dan noemen we dit smelten.
Als een vloeistof in een gas verandert, dan noemen we dit verdampen. Als een gas in een vloeistof verandert, dan noemen we dit condenseren (of condensatie). Condensatie treedt bijvoorbeeld op in de linker onderstaande afbeelding. Waterdamp in de lucht komt in aanraking met de koude fles en condenseert tot waterdruppeltjes aan de buitenkant van de fles. Ook dauw en mist ontstaan door condensatie (zie de twee rechter afbeeldingen).


 (Afbeelding: Acdx; CC BY-SA 3.0 / Taro Taylor; CC BY 2.0 / Hillebrand Steve; PD)
(Afbeelding: Acdx; CC BY-SA 3.0 / Taro Taylor; CC BY 2.0 / Hillebrand Steve; PD)
Als een gas in een vaste stof verandert, dan noemen we dit rijpen. Als het in de winter vriest, dan kan de waterdamp uit de lucht direct bevriezen. Bij het rijpen van water ontstaan kleine ijskristalletjes (zie de onderstaande afbeeldingen). De ijskristallen in de vrieskist zijn ook door rijpen ontstaan.

 (Afbeelding: Robert Reisman; CC BY 3.0 / Rubelson; CC BY-SA 4.0)
(Afbeelding: Robert Reisman; CC BY 3.0 / Rubelson; CC BY-SA 4.0)
Als een vaste stof in een gas verandert, dan noemen we dit sublimeren. Sublimeren komt minder vaak voor. Tijdens droge winterdagen zien we soms sneeuw verdwijnen, terwijl het de hele dag heeft gevroren. Sneeuw is in dat geval gesublimeerd tot waterdamp.
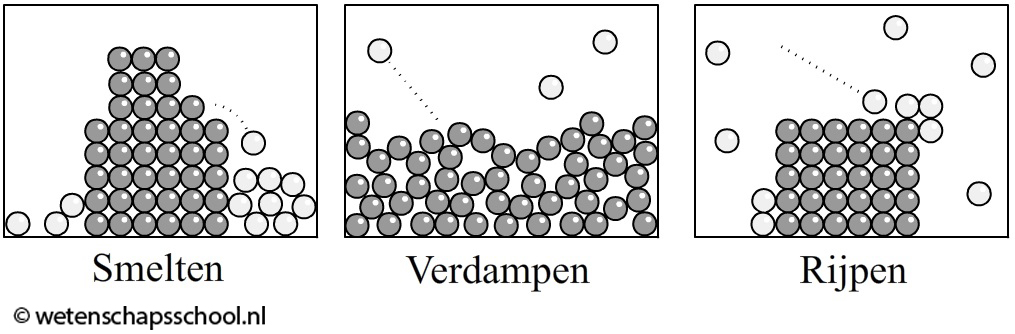
Ook faseovergangen kunnen we met behulp van deeltjes beschrijven. Linksonder is bijvoorbeeld smelten afgebeeld. Als we een vaste stof genoeg verwarmen, dan gaan de deeltjes op een gegeven moment zo hard trillen dat ze los komen van hun vaste plek. Er ontstaat dan een vloeistof. Rechtsonder zien we verdampen. Hier gaan de deeltjes van een vloeistof zo hard bewegen dat ze ontsnappen uit de vloeistof. Er ontstaat dan een gas.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Warmte
In deze paragraaf gaan we het hebben over het verschil tussen warmte en temperatuur.
Als je een kruik vult met heet water en deze tegen je lichaam houdt, dan wordt je lichaam warmer en de kruik langzaam kouder (zie de linker onderstaande afbeelding). En als je een ice pack tegen je lichaam houdt, dan wordt je lichaam kouder en de ice pack juist warmer (zie de rechter afbeelding). In beide gevallen zeggen we dat geval er warmte is verplaatst van een warme naar een koude stof.
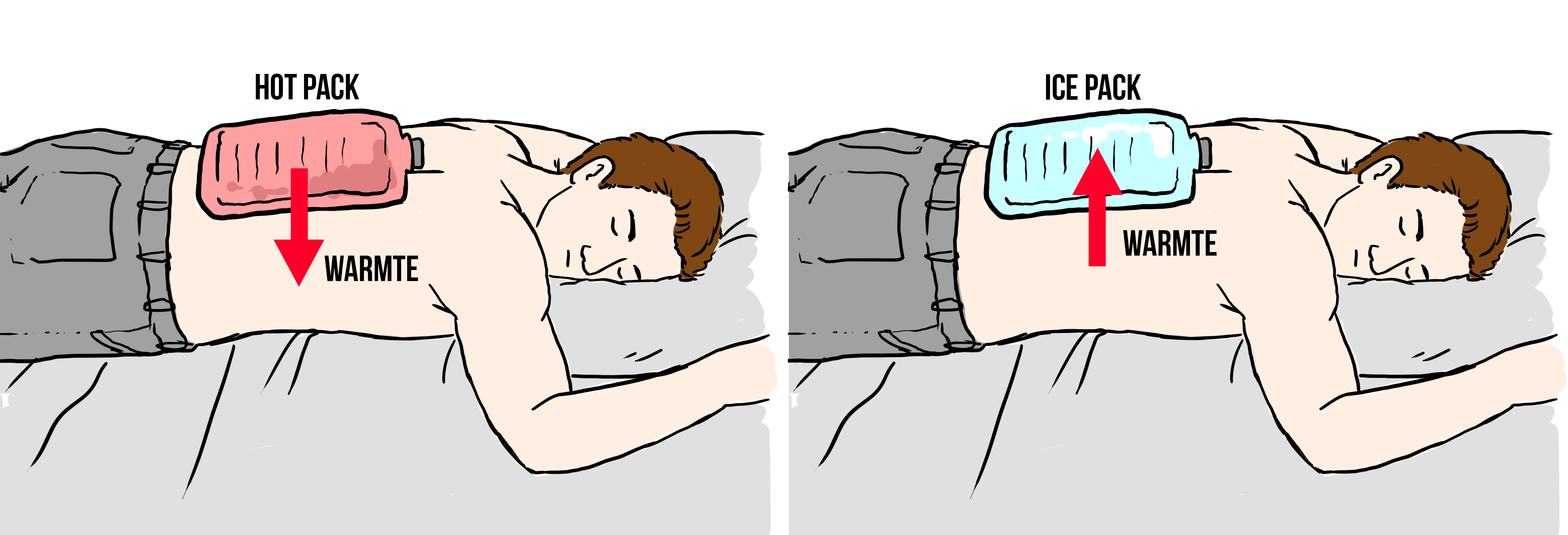
In het dagelijks leven wordt in dit voorbeeld ook wel eens gezegd dat "kou" van een koude naar een warme stof stroomt. In de natuurkunde wordt deze manier van denken echter zo veel mogelijk vermeden. Warmte is namelijk een vorm van energie en deze energie stroomt altijd van warme naar koude voorwerpen. Een zin als "doe het raam dicht, want er komt kou binnen" is natuurkundig gezien dus onhandig. Wat er in werkelijkheid gebeurt is dat er juist warmte naar buiten stroomt.
Het is belangrijk om onderscheid te maken tussen warmte en temperatuur. De temperatuur meten we met een thermometer en de eenheid hiervan is graden Celsius of kelvin. Warmte is een soort energie en de eenheid hiervan is de joule. Er geldt dus:
|
Temperatuur (T) |
kelvin (K) |
|
Energie (E) |
joule (J) |
|
Warmte (Q) |
joule (J) |
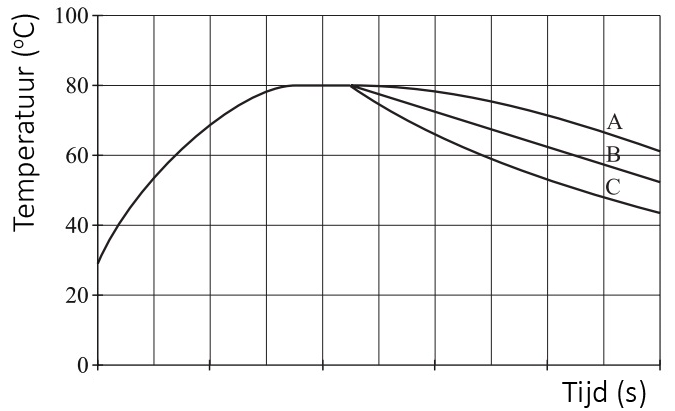
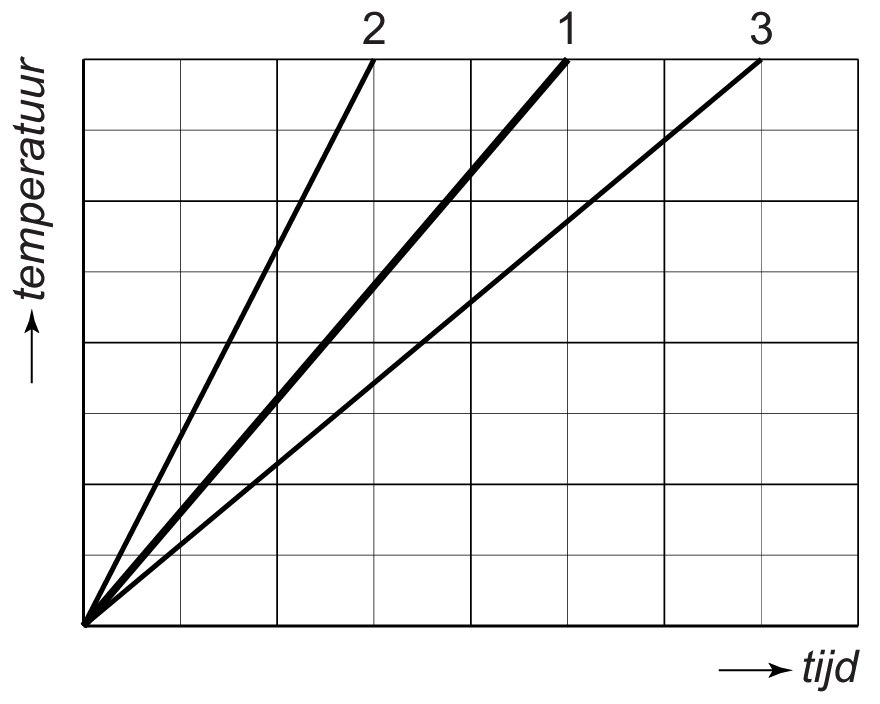
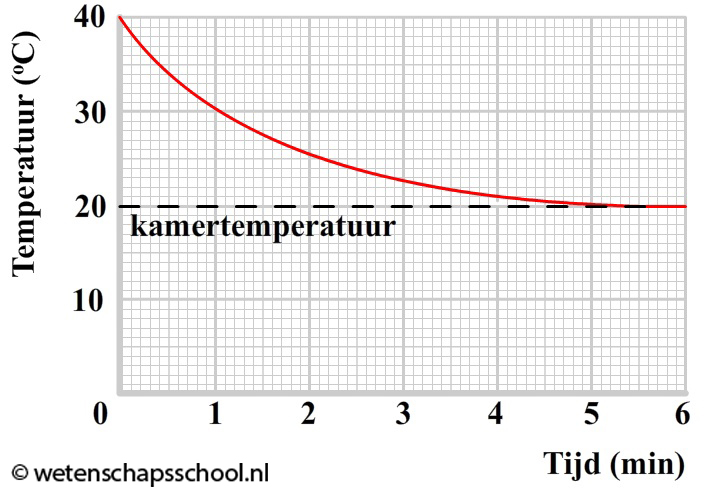
Hoeveel warmte er zal stromen van een plek met hoge temperatuur naar een plek met lage temperatuur hangt af van het temperatuurverschil tussen deze twee plekken. Hoe groter het temperatuurverschil, hoe meer warmte er zal stromen. We kunnen dit goed zien in het onderstaande diagram. Het diagram geeft het afkoelen weer van een voorwerp van 40 graden in een kamer met een omgevingstemperatuur van 20 graden Celsius. Merk op dat de temperatuur snel afneemt als het temperatuurverschil groot is. Na verloop van tijd wordt het temperatuurverschil kleiner en als gevolg neemt de temperatuur een stuk minder snel af.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Warmtetransport
In deze paragraaf gaan we drie manieren bestuderen waarop warmte kan stromen van de ene plek naar de andere.
Het stromen van warmte noemen we ook wel warmtetransport. Er bestaan drie soorten warmtetransport:
- Warmtegeleiding
- Warmtestroming
- Straling
We gaan deze drie soorten hieronder uitgebreid bespreken.
Warmtegeleiding:
Warmtegeleiding (ook wel gewoon geleiding genoemd) ontstaat doordat deeltjes hun warmte doorgeven doordat ze tegen elkaar botsen. In de onderstaande animatie zie je een stuk metaal dat aan één kant wordt verwarmd. Als gevolg gaan op deze plek de deeltjes sneller trillen. Deze deeltjes botsen dan tegen omringende deeltjes en deze worden als gevolg ook in trilling gebracht. Op deze manier trekt de warmte door het materiaal. We zien dit effect bijvoorbeeld als we een metalen lepel in een pan kokend water plaatsen. De warmte trekt dan door het metaal omhoog (zie de onderstaande afbeelding).

 Demonstratievideo
Demonstratievideo
| ||
|
Niet alle stoffen geleiden warmte even goed. Een metalen lepel in een pan met kokend water wordt bijvoorbeeld veel sneller warm dan een houten of een plastic lepel. Metaal wordt daarom een goede geleider genoemd en hout en plastic zijn slechte geleiders. Slechte geleiders worden ook wel isolatoren genoemd.

Ook gassen en vloeistoffen zijn isolatoren. Een thermosfles maakt bijvoorbeeld gebruik van de isolerende eigenschap van lucht. De wand van een thermosfles bestaat uit twee laagjes met daartussen lucht (zie de onderstaande afbeelding). Doordat lucht slecht geleid, kan de warmte hierdoor lastig de fles in en lastig de fles uit. Warme dranken blijven hierdoor langer warm en koude dranken langer koud.
Hetzelfde principe wordt toegepast bij dubbelglas. Dubbelglas bestaat uit twee glazen met daartussen lucht. Dit zorgt ervoor dat we weinig warmte verliezen via de ramen en als gevolg besteden we minder geld aan het opwarmen van ons huis. Ook via de muren ontsnapt warmte. Om dit te verminderen bestaan muren vaak uit twee delen met daartussen lucht. Dit worden ook wel spouwmuren genoemd.

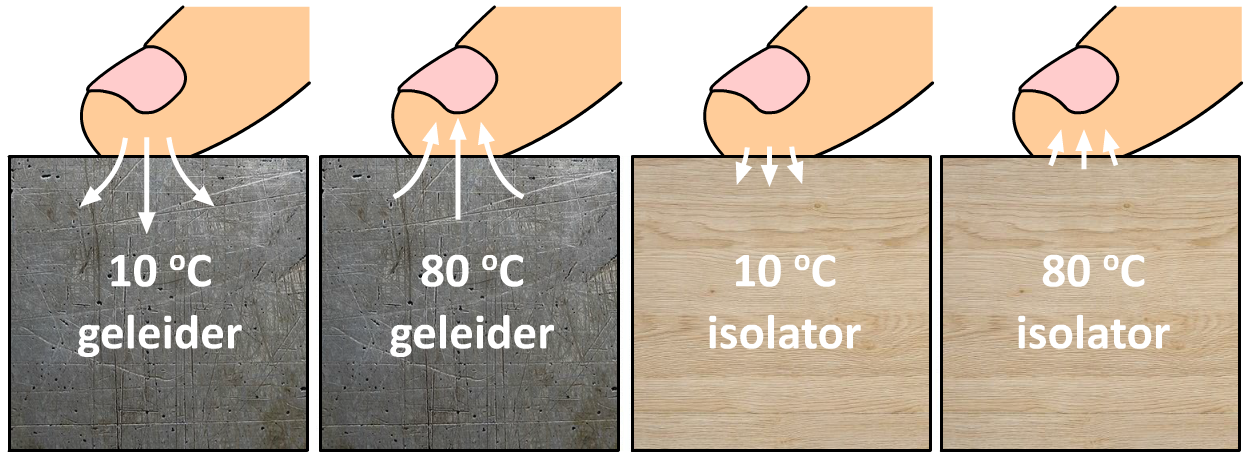
Het verschil in geleidbaarheid van verschillende stoffen kunnen we ook zien in de onderstaande afbeelding. Als je je vinger op een koude geleider legt, dan trekt de warmte van je vinger gemakkelijk in het materiaal en wordt je vinger koud. Als gevolg zeg je dat het metaal koud aanvoelt. Als je je vinger op een hete geleider legt, dan trekt de warmte gemakkelijk je vinger in. Als gevolg voelt het metaal erg heet aan. Bij een isolator is de warmteoverdracht zowel bij lage als hoge temperatuur niet groot. Als gevolg voelt dit materiaal niet snel erg heet of erg koud aan.
 Demonstratievideo
Demonstratievideo
| ||
|
Dit is ook waarom de zee bij bijvoorbeeld 20 graden Celsius veel kouder aanvoelt dan lucht bij 20 graden Celsius. Water geleid warmte namelijk een stuk beter dan lucht en kan daarom gemakkelijk de warmte uit ons lichaam trekken, waardoor we afkoelen.
Warmtestroming:
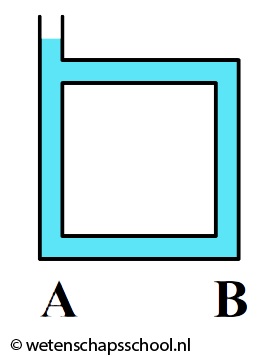
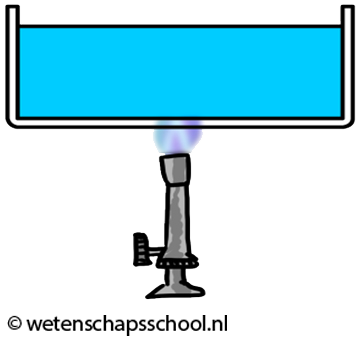
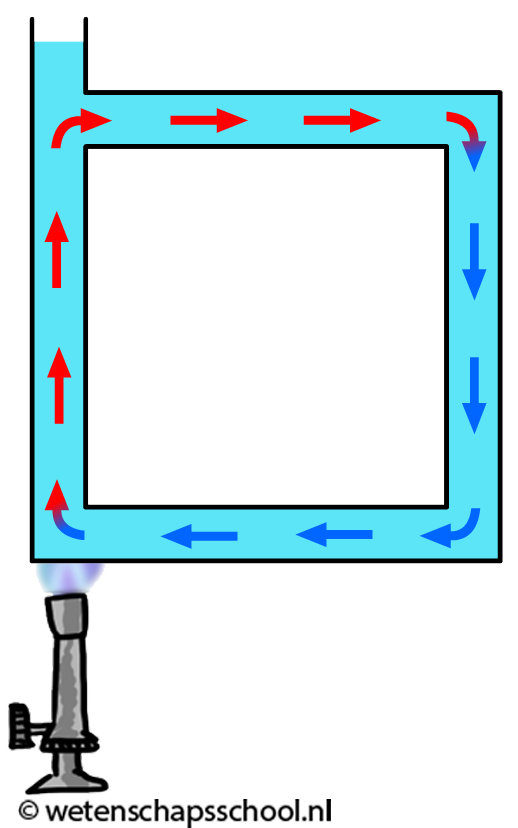
Hoewel gassen en vloeistoffen slechte geleiders zijn, kan warmte in deze stoffen wel goed worden getransporteerd met behulp van warmtestroming. We kunnen dit effect goed zien in de onderstaande linker afbeelding. We zien hier dat water in een buis verwarmd wordt. Door geleiding zal het water in de buurt van de vlam opwarmen. Dit warme water zet uit en als gevolg wordt de dichtheid van het water kleiner en zal het opstijgen. Hierdoor begint het water rond te stromen.
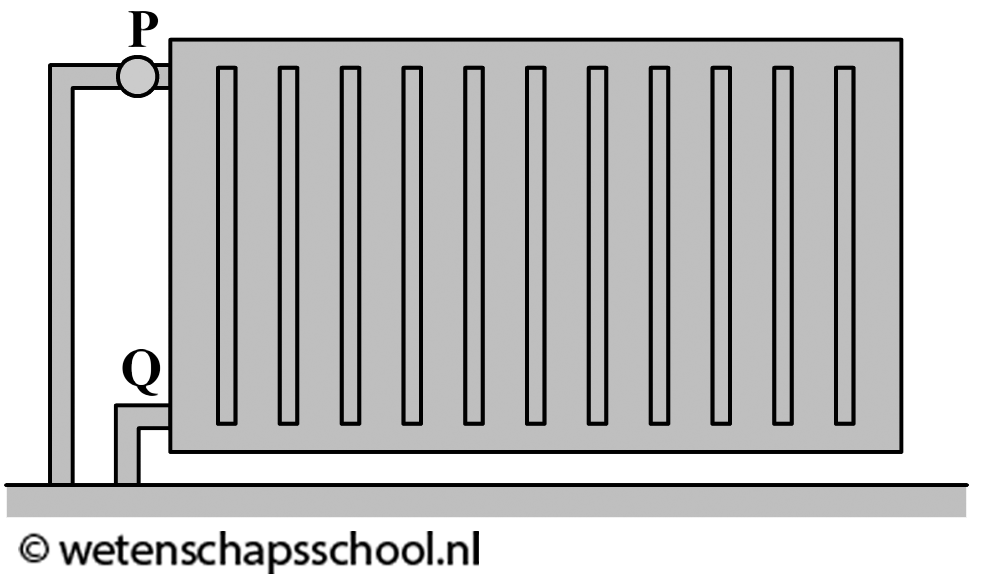
Ook het verwarmen van een kamer gebeurt op deze manier (zie de rechter afbeelding). Een warme verwarming kan met behulp van geleiding alleen de lucht verwarmen die direct in contact staat met de verwarming. Deze lucht wordt hierdoor warmer, krijgt een lagere dichtheid en stijgt op. Als gevolg ontstaat er een warmtestroom in de kamer en wordt de kamer steeds warmer.
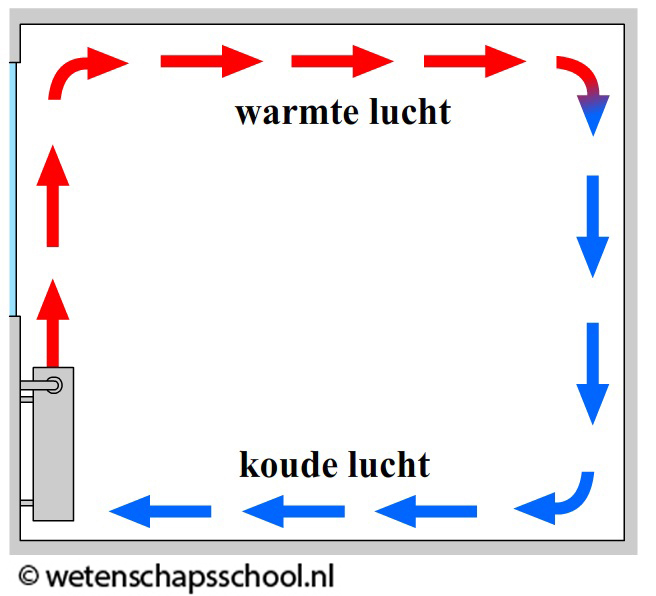
 Demonstratievideo
Demonstratievideo
| ||
|
In sommige gevallen willen we warmtestroming juist beperken. Als een huis in de winter verwarmd wordt, dan wordt de binnenwand van de spouwmuur ook warm. Er ontstaat dan tussen de binnen- en de buitenwand warmtestroming van lucht. Op deze manier komt de warmte van de binnenmuur redelijk gemakkelijk bij de buitenmuur aan en daarna ontsnapt de warmte uit het huis. Dit kan worden voorkomen door isolatiemateriaal tussen de wanden te plaatsen. Een voorbeeld hiervan is glaswol of purschuim (zie de onderstaande afbeelding). In beide stoffen zitten belletjes lucht vast in het materiaal. Als gevolg kan geen stroming optreden. De aanwezigheid van lucht beperkt in dat geval geleiding en het isolatiemateriaal zelf beperkt stroming.

Straling:
De derde soort warmtetransport wordt straling genoemd. Een ander woord voor straling is licht. Dat straling warmte kan overdragen weten we als we onze handen in de zon houden. Dit zonlicht wordt dan geabsorbeerd en hierdoor wordt onze huid warmer. Hetzelfde effect treedt ook op als je je handen warmt aan een kampvuur of openhaard (zie de linker onderstaande afbeelding).
Er is ook straling die we niet met onze ogen kunnen zien. Alle warme objecten, inclusief ons eigen lichaam, zenden bijvoorbeeld infraroodstraling uit. In de rechter afbeelding zien we een foto van warm water dat uit een kraan stroomt, gemaakt met een infraroodcamera. Zoals je ziet geeft warm water infraroodstraling af. Als je je hand naast een hete verwarming plaatst, dan kan je de infraroodstraling ook voelen (boven de verwarming is het nog warmer, maar dat komt voornamelijk door warmtestroming).

 (Afbeelding: NASA; PD / ...)
(Afbeelding: NASA; PD / ...)
 EXPERIMENT
EXPERIMENT
| ||
|
Om verlies via straling tegen te gaan, wordt soms glanzende folie tegen de muur achter een verwarming geplakt (zie de onderstaande afbeelding). De infraroodstraling die van de verwarming afkomt wordt dan terug de kamer in gereflecteerd.

Doffe en donkere voorwerpen absorberen straling het best. Deze voorwerpen worden daarom snel warm in de zon. Deze voorwerpen zenden ook weer gemakkelijk infraroodstraling uit. Als gevolg koelen ze ook weer snel af in de schaduw. Bij lichte en glimmende voorwerpen geldt het omgekeerde. Deze voorwerpen absorberen straling slecht en zenden ook weinig infraroodstraling uit. Als je een huis hebt in een warm land, dan is het dus handig dit huis wit te verven, zodat het binnen overdag koel blijft.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Verwarmen
In deze paragraaf gaan we rekenen aan warmte.
Als we willen weten hoeveel warmte er nodig is om de temperatuur van een vloeistof een bepaalde hoeveelheid te laten stijgen, dan gebruiken we daarvoor een joulemeter (ook wel calorimeter genoemd). Een joulemeter is niets anders dan een geïsoleerd bakje met daarin een verwarmingselement en een thermometer (zie de onderstaande afbeelding).
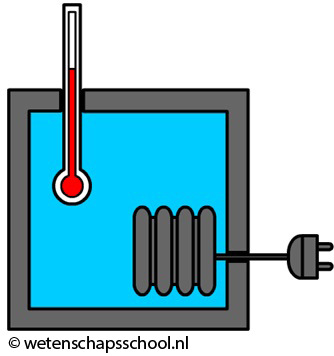
In het bovenstaande voorbeeld is een joulemeter gevuld met water. In het verwarmingselement wordt elektrische energie omgezet in warmte en met deze warmte wordt het water verwarmd. De hoeveelheid elektrische energie kunnen we uitrekenen met de formule "E = Pt" uit het hoofdstuk "Elektriciteit". Omdat de elektrische energie in een joulemeter omgezet wordt in warmte (Q), kunnen we deze formule ook schrijven als:
$$ Q = P \times t $$
|
Met deze formules kan je dus uitrekenen hoeveel elektrische energie is omgezet in warmte. Met een thermometer kunnen we dan de temperatuurstijging aflezen. We kunnen op deze manier achterhalen hoeveel energie het kost om de temperatuur van een stof een graad Celsius te laten stijgen.
Bij een kilogram water vindt men met dit experiment bijvoorbeeld dat er 4180 joule nodig is om de temperatuur een graad Celsius te laten stijgen. Het is niet nodig deze waarde uit je hoofd te weten.
Veel huizen worden verwarmd met een cv-ketel. Hierin wordt water verwarmd door middel van de verbranding van aardgas. De chemische energie in aardgas wordt hierbij omgezet in warmte. In BINAS kunnen we vinden dat de verbrandingswarmte van aardgas gelijk is aan 32 J/cm3. Dit betekent dat er 32 joule aan chemische energie zit opgeslagen in één kubieke centimeter aardgas.
 Demonstratievideo
Demonstratievideo
| ||
|
Een deel van de warmte zal echter ontsnappen door de wanden van het huis. Er is dus een verschil tussen de totale energie (Etot) die gebruikt is en de energie die nuttig gebruikt is (Enuttig). De fractie van de energie die nuttig gebruikt wordt (en dus niet verloren gaat) noemen we het rendement. Het rendement kunnen we als volgt berekenen:
| $$ \frac{E_{nuttig}}{E_{tot}} = \eta $$ |
Het rendement in deze formule is een getal tussen de 0 en de 1. Het rendement wordt ook vaak uitgedrukt als percentage. In dat geval moet het rendement uit deze formule vermenigvuldigd worden met 100. Een rendement van 0,05 komt dus overeen met een rendement van 5%.
 Voorbeeld
Voorbeeld
| ||||||||
|
Opdracht: Voor het opwarmen van een woonkamer wordt 12,0 dm3 aardgas verbrand. Bereken hoeveel energie hierbij vrijkomt. Antwoord: Eerst rekenen we het volume aardgas om naar kubieke centimeter. 12 dm3 is gelijk aan 12 000 cm3. Volgens BINAS is de verbrandingswarmte van aardgas gelijk aan 32 J/cm3. Met een verhoudingstabel kunnen we hiermee uitrekenen hoeveel energie er in totaal gebruikt is:
Er is dus 384 000 joule nodig om de kamer te verwarmen. Opdracht: Tijdens het verwarmen van de kamer ontsnapt 35 000 joule van de warmte door de wanden van het huis. Bereken het rendement van het verwarmen van de kamer. Antwoord: Het rendement vertelt ons hoeveel procent van de energie nuttig gebruikt is. In de vorige vraag hebben we berekend dat in totaal 384 000 J gebruikt wordt. In deze vraag staat dat hiervan 35 000 J aan warmte verloren is gegaan. Er is dan 384 000 - 35 000 = 349 000 J nuttig gebruikt. Er geldt dus: Enuttig = 349 000 J Etot = 384 000 J Hiermee berekenen we het rendement: $$ \eta = \frac{E_{nuttig}}{E_{tot}} $$ $$ \eta = \frac{349 000 }{384 000} = 0,91 $$Het rendement is dus 91%. Opdracht: Vóór het verwarmen was de temperatuur van de kamer 17 oC. In de vorige vraag hebben we geleerd dat 349 000 J aan energie nuttig gebruikt werd om de kamer op te warmen. Antwoord: Dit lossen we weer op met een verhoudingstabel. We gebruiken dat 1 oC overeenkomt met 1,29 × 105 J aan energie. We willen weten welke temperatuurstijging hoort bij een warmte van 349 000 J:
De temperatuur is dus 2,7 oC toegenomen. We begonnen bij een temperatuur van 17 oC. De temperatuur na het verwarmen wordt hiermee 17 + 2,7 = 19,7 oC.
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||||||||
|
| BINAS: | |
| 7-12 | Formules |
| 15-17 | Smeltpunt en kookpunt |
| 19 | Verbrandingswarmte |