Hoofdstuk 3
Experimenteren
§1 Veiligheid §2 Experimenteren §3 Stofeigenschappen §4 Chemische reacties en faseovergangen §5 Atomen en moleculen
§1 Veiligheid
In de scheikunde werken we vaak met chemicaliën. Voordat we gaan experimenteren met deze stoffen is het van belang dat je hier veilig mee om kan gaan. In deze paragraaf lees je hier meer over.
Bij het gebruik van stoffen is het van belang eerst op het etiket te kijken naar de zogenaamde gevarenpictogrammen. Hieronder zie je een aantal pictogrammen waarvan je de betekenis uit je hoofd moet kennen. De pictogrammen staan ook in BINAS. In de onderstaande tabel zijn een aantal pictogrammen toegelicht.

|
Pictogram |
Betekenis |
|
Onder druk |
Een fles kan exploderen of de dop kan er hard afschieten als de fles te warm wordt. |
|
Schadelijk |
Deze stof is irriterend of schadelijk voor de huid en ogen of bij het inademen of inslikken. |
|
Corrosief |
Deze stof reageert bijtend op de huid en kan ook bepaalde materialen aantasten. |
|
Langetermijn-schade |
De schade bij deze stoffen is niet direct merkbaar, maar wel op lange termijn. Denk bijvoorbeeld aan kankerverwekkende stoffen. |
|
Ontvlambaar |
Deze stof kan gemakkelijk ontbranden. |
|
Oxiderend |
Deze stof kan andere stoffen gemakkelijk laten ontbranden of kan verbranding heftiger maken. |
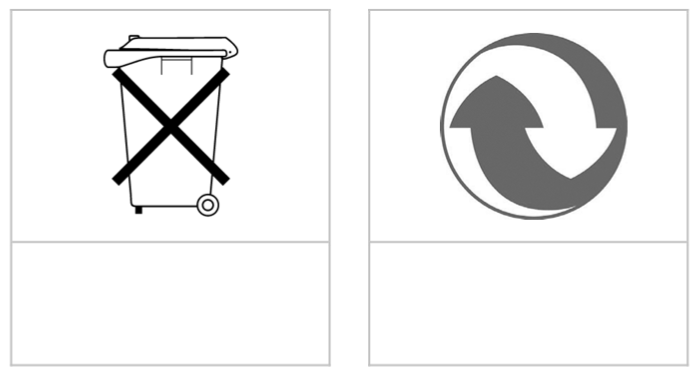
Hiernaast zien we nog een laatste symbool. Dit symbool staat niet in BINAS, maar moet je toch kennen. Het symbool wil zeggen dat je de stof niet mag mengen met andere stoffen, bijvoorbeeld omdat dan giftige gassen vrij kunnen komen.

Door de gevaren die bepaalde stoffen met zich meebrengen, kan je wellicht begrijpen dat er ook regels zijn over het verwerken van afval. Neem bijvoorbeeld klein chemisch afval (KCA). Dit is huishoudelijk afval dat chemische stoffen bevat die schadelijk kunnen zijn voor de gezondheid en het milieu. Denk bijvoorbeeld aan batterijen, terpentine of spaarlampen. Dit afval wordt apart ingezameld en speciaal verwerkt.
Sommige soorten afval kunnen we hergebruiken. Dit wordt ook wel recyclen genoemd. Dit gebeurt bijvoorbeeld met plastic en papier, maar ook met metalen zoals staal. Groente, fruit en tuinafval (afgekort als GFT) wordt apart ingezameld en dan wordt er compost van gemaakt. Dit wordt gebruikt als mest om de groei van gewassen te bevorderen.
Niet al het afval kunnen we echter recyclen. Als dit niet lukt, dan wordt afval verbrand of gestort op een vuilnisbelt. Verbranden heeft als voordeel dat de warmte die hierbij vrijkomt nuttig gebruikt kan worden (bijvoorbeeld voor het verwarmen van water of het opwekken van elektriciteit), maar er kunnen ook schadelijke stoffen bij vrijkomen.
In BINAS kan je voor een aantal soorten afval vinden wat hiermee gedaan wordt. Je kan hier ook het symbool vinden voor recyclen en voor klein chemisch afval. Ook kan je voor een aantal gevaarlijke stoffen vinden waar je op moet letten en hoe lang het duurt voordat sommige typen afval vergaan of verteren (dit noemen we ook wel de afbraaktijd). In een filmpje op de website laat ik deze tabellen zien.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Experimenteren
In deze paragraaf komen we dan eindelijk toe aan het uitvoeren van experimenten. In de theorie bespreken we een aantal materialen die we gebruiken bij experimenteren.
Als we stoffen willen mengen of verwarmen, dan doen we deze stoffen vaak eerst in glaswerk. Een bekend voorbeeld is de reageerbuis. Dit is een lang, dun, glazen buisje dat wordt gebruikt als we werken met kleine hoeveelheden stof (zie de onderstaande linker afbeelding). Door de onderkant van een reageerbuis rustig heen en weer te schudden (te kwispelen) kan je de stoffen die erin zitten voorzichtig mengen. Als harder schudden nodig is, kan je de reageerbuis dichtmaken met een rubberen stop (zie de rechter afbeelding). Met een reageerbuisknijper kan de reageerbuis opgepakt worden en in een vlam verhit worden.


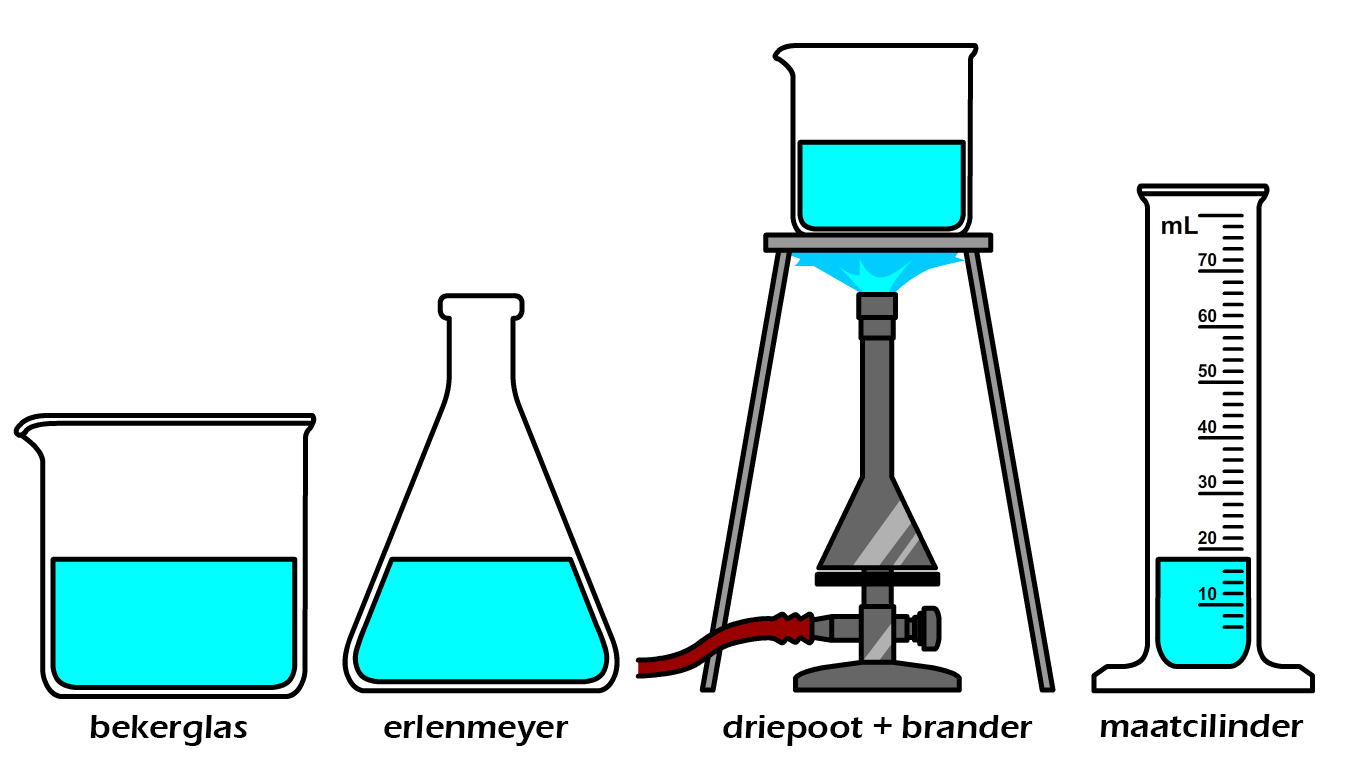
Een type glaswerk waar we meer stof in kwijt kunnen is het bekerglas (zie de eerste onderstaande afbeelding). Daarnaast hebben we ook de erlenmeyer (zie de tweede afbeelding). Een erlenmeyer heeft een brede bodem en een smalle hals en als gevolg kan je dit type glaswerk gemakkelijk schudden zonder te morsen. Zowel het bekerglas als de erlenmeyer kunnen ook verwarmd worden met een brander. Ze worden hiervoor eerst op een driepoot gezet (zie de derde afbeelding). Een ander type glaswerk is de maatcilinder (zie de vierde afbeelding). Een maatcilinder is een lange cilinder met op de zijkant een maatverdeling waarmee we het volume van vloeistoffen kunnen bepalen. Meestal wordt de maatverdeling gegeven in milliliters. Maatcilinders zijn niet bedoeld om te verwarmen.
Om stoffen te verwarmen gebruiken we een gasbrander (zie de onderstaande afbeelding). De branders in het scheikundelokaal werken op aardgas. Dit gas bestaat voornamelijk uit het brandbare methaan (CH4). Dit gas is kleurloos en geurloos en daarom niet door mensen te detecteren. Omdat het gevaarlijk kan zijn als dit gas in een afgesloten ruimte ontsnapt, is een geur toegevoegd, zodat we het aardgas direct kunnen herkennen. Als we het aardgas met een lucifer aansteken, dan reageert het gas met de zuurstof in de lucht. Bij deze reactie komt warmte en licht vrij—er ontstaat vuur.
Als je met de gasbrander wilt werken, zorg je eerst dat de twee draaiknoppen van de brander dicht zijn. De onderste knop regelt de gastoevoer. Draai deze knop een beetje open en steek het gas met een lucifer aan. Als het goed is krijg je nu een gele vlam te zien. Door de gastoevoer nog verder open te draaien wordt de vlam groter.
 (Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
(Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
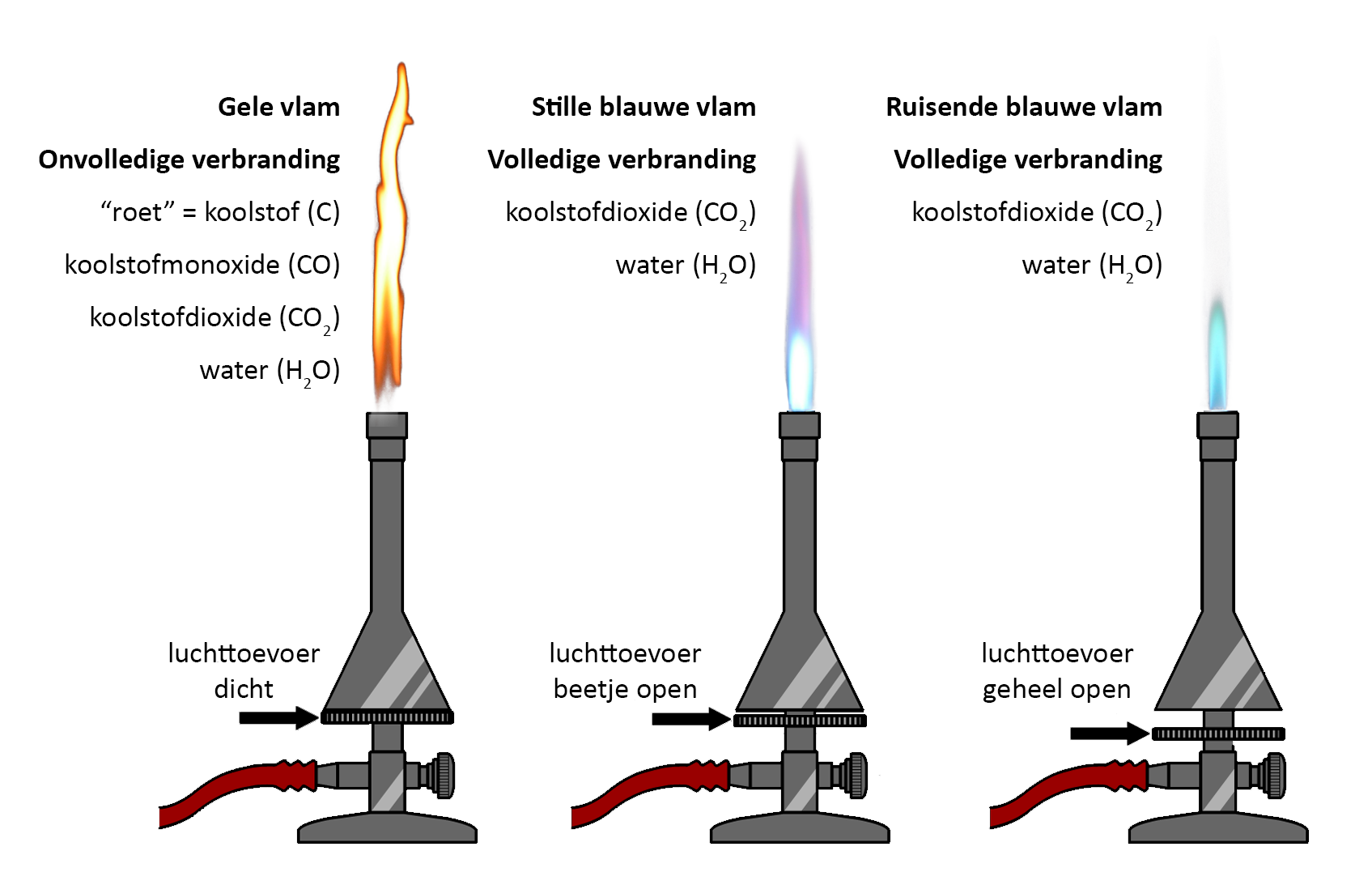
De bovenste knop regelt de luchttoevoer. Op dit moment is deze knop nog dicht en als gevolg kan er maar weinig zuurstof bij de vlam komen. We spreken in dit geval van onvolledige verbranding. Bij dit type verbranding komt naast water (H2O) en koolstofdioxide (CO2) ook koolstof (C) en koolstofmonoxide (CO) vrij. Koolstofmonoxide is een onzichtbaar gas dat bij hoge concentratie gevaarlijk is voor de mens en zelfs dodelijk kan zijn. Dit is waarom veel mensen in huis een koolstofmonoxidemelder hebben hangen. Koolstof is een zwarte vaste stof die we in het dagelijks leven "roet" noemen. Het ontstaan van roet merken we bijvoorbeeld als we een stukje glas in een gele vlam houden (zie de onderstaande afbeelding). Omdat we geen roet op ons glaswerk willen hebben, wordt een gele vlam niet gebruikt voor het verwarmen van materialen. Als we brander even niet gebruiken, gebruiken we wel de gele vlam, omdat deze vlam het best zichtbaar is. De gele vlam wordt daarom ook wel de waarschuwingsvlam genoemd.
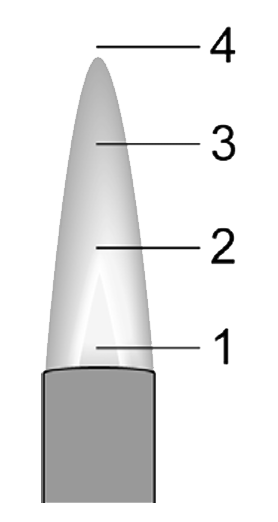
Als we stoffen willen verwarmen, dan zetten we de luchttoevoer verder open. Als we dit geleidelijk doen, zullen we eerst zien dat de vlam blauw wordt. Bij grote hoeveelheden zuurstof gaat de vlam daarnaast ook hoorbaar ruisen en wordt er een lichtblauwe kern in de vlam zichtbaar. We noemen deze vlammen de stille blauwe vlam en de ruisende blauwe vlam. De drie vlammen kan je in de onderstaande linker afbeelding zien. Hoe meer we de luchttoevoer openzetten, hoe heter de vlam wordt. Het topje van de lichtblauwe kern is het heetste deel van de vlam en daar worden dan ook materialen gehouden die we sterk willen verhitten.
Bij de blauwe vlam en de ruisende vlam vindt volledige verbranding plaats. Bij dit type verbranding ontstaat alleen koolstofdioxide (CO2) en waterdamp (H2O). Waterdamp en koolstofdioxide zijn beide kleurloze en geurloze gassen. Ze zijn daardoor niet zichtbaar. We kunnen de aanwezigheid van deze stoffen wel aantonen met behulp van andere stoffen. De aanwezigheid van water of waterdamp kunnen we aantonen door het water te laten reageren met wit kopersulfaat. Deze stof krijgt na aanraking met water een blauwe kleur (zie de linker onderstaande afbeelding). Koolstofdioxide kan worden aangetoond door dit gas door helder kalkwater te laten stromen. Na aanraking met CO2 wordt deze vloeistof troebel wit (zie de onderstaande rechter afbeelding).

 (Afbeelding: Benjah-bmm27; PD / CaesiumFluoride; CC BY-SA 3.0)
(Afbeelding: Benjah-bmm27; PD / CaesiumFluoride; CC BY-SA 3.0)
 Demonstratievideo
Demonstratievideo
|
| In deze video's zie je de reactie tussen wit kopersulfaat en water. Hierbij wordt het witte kopersulfaat blauw. |
 EXPERIMENT
EXPERIMENT
| ||
|
In de onderstaande afbeelding zijn de stoffen die ontstaan bij de verschillende vlammen nog eens overzichtelijk weergegeven:

 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Stofeigenschappen
In deze paragraaf gaan we stofeigenschappen bespreken. Dit zijn de eigenschappen waaraan we stoffen kunnen herkennen.
Sommige eigenschappen van stoffen kunnen gebruikt worden om de stoffen te herkennen. We noemen dit stofeigenschappen. Een stuk goud heeft bijvoorbeeld altijd deze eigenschappen:
- Gele kleur
- Glanzend
- Vast bij kamertemperatuur
- Vervormbaar
- Goede geleider van elektriciteit
- Niet brandbaar
- Smeltpunt van 1064 graden Celsius
- Kookpunt van 2856 graden Celsius
- Dichtheid van 19,3 g/cm3
Als we een stof vinden met al deze eigenschappen, dan weten we dat dit goud is. Als het één van deze eigenschappen niet heeft, dan weten we zeker dat het geen goud is.
Niet alle eigenschappen van een stof zijn ook meteen stofeigenschappen. Als je een stuk goud hebt met een massa van 500 gram dan wil dat niet zeggen dat elk stuk goud een massa van 500 gram heeft. Massa is dus geen stofeigenschap. De dichtheid van goud is wel een stofeigenschap, want de dichtheid van elk stuk goud is 19,3 g/cm3.
Ook de fase van een stof is geen stofeigenschap. Elke stof bevindt zich in een van de volgende drie fasen:
- Vast
- Vloeibaar
- Gas
Goud kan voorkomen als vaste stof, maar ook als vloeistof of gas en daarom is de fase geen stofeigenschap. De fase bij kamertemperatuur is wel een stofeigenschap. Goud is bij kamertemperatuur immers altijd een vaste stof.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Chemische reacties en natuurkundige processen
In deze paragraaf gaan we het verschil tussen faseovergangen en natuurkundige processen bestuderen.
Scheikunde gaat over de eigenschappen van stoffen en wat er gebeurt als we deze stoffen mengen. In sommige omstandigheden kunnen stoffen veranderen in compleet andere stoffen. Als dit gebeurt, spreken we van een chemische reactie. Bijvoorbeeld een kleurverandering of een verbranding is een aanwijzing dat er een chemische reactie heeft plaatsgevonden.
Een bekend voorbeeld van een chemische reactie is de verbrandingsreactie. In de linker onderstaande afbeelding zien we de verbranding van staalwol. Staalwol bestaat voornamelijk uit ijzer en bij hoge temperaturen reageert het met de zuurstof in de lucht. Dit gebeurt bijvoorbeeld als je een batterij tegen staalwol aanhoudt. Bij de verbranding van ijzer ontstaat ijzeroxide. In het dagelijks leven noemen we dit ook wel "roest". Bij deze reactie is zuurstof en ijzer dus veranderd in een nieuwe stof: ijzeroxide. Er heeft dus een chemische reactie plaatsgevonden. In de natuur roest ijzer ook, maar dat gaat veel langzamer (zie de rechter afbeelding).

 (Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
(Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
Een ander voorbeeld van een chemische reactie treedt op als we carbid (ook wel calciumcarbide genoemd) combineren met water. Er ontstaat hierbij de stof ethyn. Als we de stof ethyn combineren met lucht en dan aansteken, dan ontstaat een explosie. In sommige delen van Nederland wordt rond de jaarwisseling carbid en water in een melkbus gedaan. Bij het ontsteken schiet de dop van de melkbus soms meters ver weg en is een grote knal te horen en een vlam te zien (zie de onderstaande afbeelding en het onderstaande filmpje).
 (Afbeelding: Jjdez; CC BY-SA 3.0)
(Afbeelding: Jjdez; CC BY-SA 3.0)
 EXPERIMENT
EXPERIMENT
| ||
|
Het is belangrijk chemische reacties te kunnen onderscheiden van natuurkundige processen. Bij een natuurkundig proces verandert een stof, maar er ontstaat geen nieuwe stof en er is dan dus ook geen sprake van een chemische reactie. Een voorbeeld hiervan zijn faseovergangen. Denk bijvoorbeeld aan het smelten van ijs of het koken van water. Of je water nu in gas-, vloeibare- of vaste vorm tegenkomt, het blijft water. Bij een faseovergang ontstaat dus geen nieuwe stof en daarom is een faseovergang geen chemische reactie, maar een natuurkundig proces.
Een ander voorbeeld is het uitzetten of krimpen van een gas door dit gas te verwarmen of af te koelen. Als we bijvoorbeeld een ballon in extreem koud vloeibaar stikstof duwen, dan wordt het gas kouder en daardoor krimpt de ballon (zie hoofdstuk “Temperatuur”). Dit is ook een voorbeeld van een natuurkundig proces, want er ontstaan bij deze verandering geen nieuwe stoffen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Atomen en moleculen
In deze paragraaf gaan we het hebben over de deeltjes waaruit stoffen bestaan. We noemen dit ook wel atomen. Atomen kunnen zich combineren tot o.a. moleculen en metaalroosters.
De wereld bestaat uit miljoenen soorten stoffen, maar al deze stoffen blijken te bestaan uit een combinatie van slechts 118 soorten kleine bolvormige deeltjes die we atomen noemen. Elk van de 118 atoomsoorten heeft een naam en een symbool. Dit symbool bestaat uit een hoofdletter en in sommige gevallen ook een kleine letter. Hieronder zijn al deze atomen genoteerd in een tabel die we het periodiek systeem der elementen noemen.
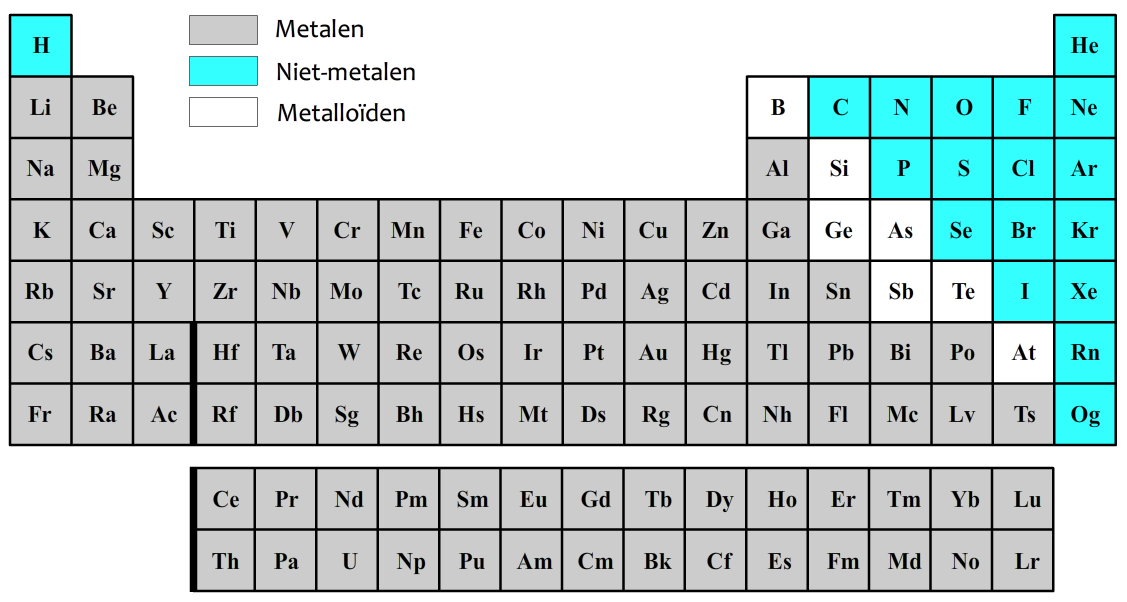
Zoals je hierboven kan zien kan je de atomen opdelen in o.a. metalen en niet-metalen. Metalen zijn te herkennen aan de volgende stofeigenschappen:
- Ze glimmen als ze gepolijst zijn
- Ze zijn buigbaar
- Ze zijn goede geleiders van warmte en elektriciteit
- Ze zijn vast bij kamertemperatuur (behalve kwik, dit is vloeibaar bij kamertemperatuur)
- De meeste metalen zijn grijs, maar zeker niet allemaal. Goud is bijvoorbeeld geel en koper is oranje.
Veel metalen reageren langzaam met zuurstof. Dit wordt ook wel oxideren of corrosie genoemd. Alleen de oxidatie van ijzer noemen we ook wel roesten. Een groot nadeel van de corrosie van ijzer is dat roest erg broos is en zuurstof daardoor gemakkelijk bij het ijzer komt onder de roestlaag, waardoor het verder blijft roesten (zie de linker onderstaande afbeelding). Dit werkt anders bij bijvoorbeeld chroom. Dit metaal is meer corrosiebestendig omdat het een dun en hard oxidelaagje vormt dat het metaal eronder beschermt tegen verdere corrosie. Bij chroom is dit laagje doorzichtig, waardoor het glimmende metaal eronder goed zichtbaar blijft. Dit is de reden dat bijvoorbeeld ijzeren kranen vaak met een laagje chroom worden bedekt. Dit wordt verchromen genoemd (zie de afbeelding rechtsonder). Een andere manier om ijzer te beschermen tegen corrosie is door het te bedekken met een laagje zink (dit wordt galvaniseren genoemd), maar je kan het ijzer natuurlijk ook gewoon verven.

 (Afbeelding: ... / Matthew Bowden; www.digitallyrefreshing.com; PD )
(Afbeelding: ... / Matthew Bowden; www.digitallyrefreshing.com; PD )
De rest van de theorie in deze paragraaf is geen CE-stof
Als we metaalatomen samenbrengen, dan ordenen ze zich in vaste vorm meestal in een regelmatig patroon dat een metaalrooster wordt genoemd (zie de onderstaande afbeelding).

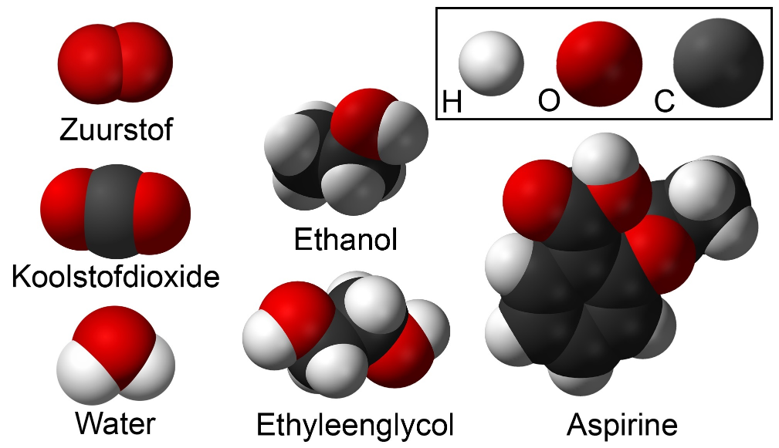
En dan nu de niet-metalen. Als we niet-metaalatomen samenbrengen, dan groeperen ze zich meestal in vaste combinaties die we moleculen noemen. In de middelste onderstaande afbeelding zien we bijvoorbeeld twee watermoleculen. Moleculen beschrijven we met behulp van een molecuulformule. De molecuulformule van een watermolecuul is H2O, omdat het uit twee waterstofatomen (H2) en één zuurstofatoom (O) bestaat.

De molecuulformule H2O bestaat dus uit drie atomen (twee keer een H en één keer een O) en bestaat uit twee atoomsoorten (H en O).
Het soort molecuul bepaalt met welk soort stof we te maken hebben. Neem bijvoorbeeld de onderste twee moleculen. Een waterstofperoxidemolecuul (H2O2) bevat slechts één zuurstofatoom meer dan water, maar toch is het een geheel andere stof. Waterstofperoxide wordt bijvoorbeeld gebruikt voor het blonderen van haar!
 Bron: S. Nova (glas water)
Bron: S. Nova (glas water)
Hieronder zien we een aantal moleculen die we kunnen maken met alleen de atomen waterstof (H), zuurstof (O) en koolstof (C):
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
De rest van de opdrachten in deze paragraaf zijn geen CE-stof
|
| BINAS: | |
| 15-17 | Smeltpunt en kookpunt |
| 31 | Pictogrammen |
| 32 | Elementen |
| 34 | Periodiek systeem |
| 37 | Legeringen |
| 40 | Gevaarlijke stoffen |
| 43 | Afval |