Hoofdstuk 8
Atomen en moleculen
(ALLEEN ONLINE)s
§1 Chemische reacties §2 Het periodiek systeem §3 Metalen §4 Moleculaire stoffen §5 Scheiden en ontleden
§1 Chemische reacties
In dit hoofdstuk introduceren we de scheikunde. We beginnen met het beschrijven van chemische reacties.
Scheikunde gaat over de eigenschappen van stoffen en wat er gebeurt als we deze stoffen mengen. In sommige omstandigheden kunnen stoffen veranderen in compleet andere stoffen. Als dit gebeurt, spreken we van een chemische reactie.
Een bekend voorbeeld van een chemische reactie is de verbrandingsreactie. In de eerste onderstaande afbeelding zien we de verbranding van staalwol. Staalwol bestaat voornamelijk uit ijzer en bij hoge temperaturen reageert het met de zuurstof in de lucht. Bij de verbranding van ijzer ontstaat ijzeroxide (roest). De zuurstof en het ijzer zijn dus veranderd in een nieuwe stof en dit betekent dat er een chemische reactie heeft plaatsgevonden. In de natuur roest ijzer ook, maar dat gaat veel langzamer (zie de tweede afbeelding).

 (Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
(Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
Chemische reacties beschrijven we met een reactieschema. In een reactieschema schrijven we schematisch op welke stoffen voor de reactie aanwezig waren (de reactanten) en welke stoffen na de reactie zijn ontstaan (de producten). Tussen de reactanten en de producten schrijven we een pijltje:
$$ \text{reactant 1} + \text{reactant 2} + \text{...} \;\;\; \rightarrow \;\;\; \text{product 1} + \text{product 2} + \text{...} $$Laten we als voorbeeld de verbranding van staalwol nemen. De reactanten zijn in dit geval ijzer en zuurstof en het product is ijzeroxide. We schrijven dit als volgt op:
$$ \mathrm{ijzer} + \mathrm{zuurstof} \rightarrow \mathrm{ijzeroxide} $$Het is belangrijk om chemische reacties te onderscheiden van faseovergangen. Bij een faseovergang ontstaat namelijk geen nieuwe stof. We krijgen gewoon dezelfde stof te zien, alleen dan in een andere fase. Of je water nu in gas-, vloeibare- of vaste vorm tegenkomt, het blijft water. Een faseovergang is daarom geen chemische reactie.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Het periodiek systeem
In deze paragraaf bestuderen we verschillende soorten atomen.
De wereld bestaat uit kleine bolvormige deeltjes die we atomen noemen. Er bestaan 118 soorten atomen. Al deze soorten hebben een naam en een symbool. Dit symbool bestaat uit een hoofdletter en in sommige gevallen ook een kleine letter. Deze symbolen staan in de onderstaande tabel, genaamd het periodiek systeem der elementen. De atoomsoorten die grijs zijn weergegeven noemen we metalen. De atoomsoorten die blauw zijn weergegeven noemen we niet-metalen.
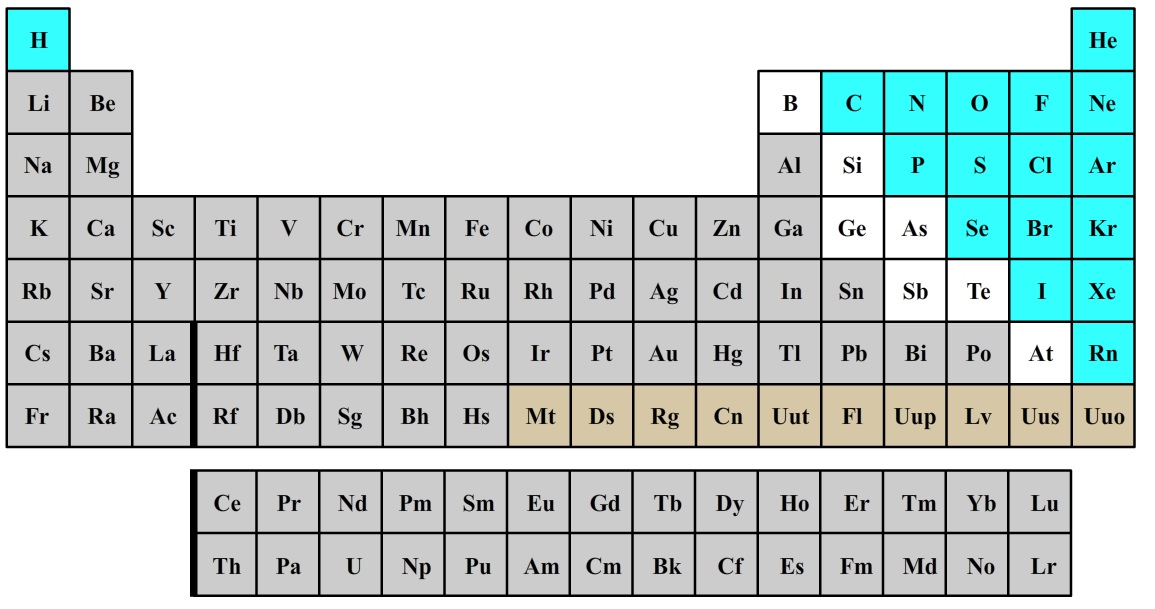
De volgende atoomsoorten en de bijbehorende symbolen moet je uit het hoofd kennen:
|
Metaalatomen |
Niet-metaalatomen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Chroom |
Cr |
Zuurstof |
O |
|
IJzer |
Fe |
Zwavel |
S |
|
Nikkel |
Ni |
Fluor |
F |
|
Platinum |
Pt |
Chloor |
Cl |
|
Koper |
Cu |
Broom |
Br |
|
Zilver |
Ag |
Jood |
I |
|
Goud |
Au |
Helium |
He |
|
Zink |
Zn |
Neon |
Ne |
|
Aluminium |
Al |
Argon |
Ar |
|
Tin |
Sn |
|
|
|
Lood |
Pb |
|
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
Ga naar deze opdracht op de website en speel de twee programma's uit.
|
§3 Metalen
In deze paragraaf bestuderen we een aantal eigenschappen van metalen.
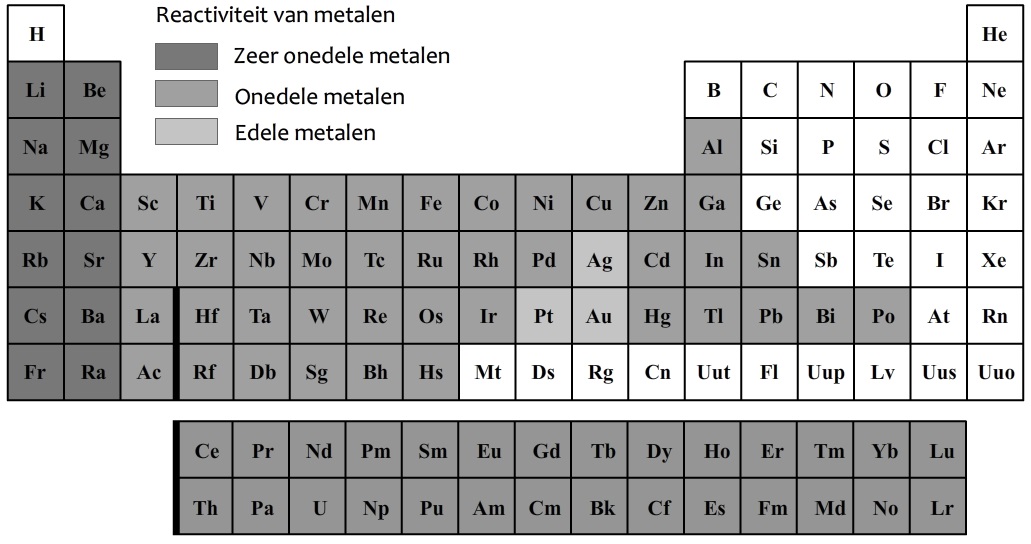
In de onderstaande afbeelding zijn de metalen in het periodiek systeem in het grijs aangegeven. De metalen in de eerste twee kolommen van het periodiek systeem worden de zeer onedele metalen genoemd. Deze metalen zijn extreem reactief. De stoffen in de eerste kolom reageren bijvoorbeeld heel heftig met water.
De stoffen zilver (Ag), goud (Au) en platinum (Pt) worden de edele metalen genoemd. Deze metalen reageren niet of nauwelijks met andere stoffen. De overige metalen noemen we de onedele metalen. Deze metalen zijn wel reactief, maar deze reacties verlopen meestal langzaam.
Het reageren van een metaal met zuurstof noemen we oxideren. Het bekendste voorbeeld hiervan is het oxideren van ijzer. We noemen dit roesten. Een ander bekend voorbeeld is het oxideren van koper. Geoxideerd koper is lichtgroen. Het vrijheidsbeeld in New York is hier bijvoorbeeld van gemaakt.
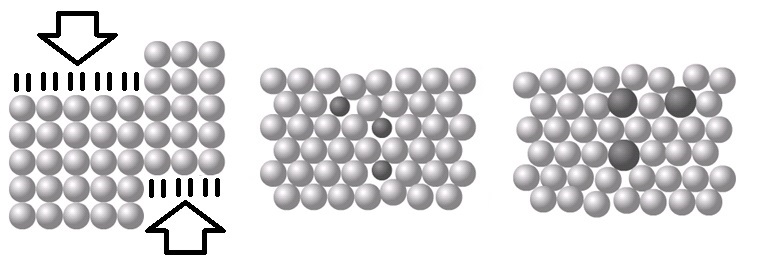
Als we metaalatomen samenbrengen, dan ordenen ze zich meestal in een regelmatig patroon dat een metaalrooster wordt genoemd (zie de onderstaande afbeelding).

Een zuiver metaal bestaat slechts uit één soort atoom en de metaalroosters zijn daardoor erg geordend. Het gevolg hiervan is dat de atomen in deze roosters gemakkelijk langs elkaar kunnen worden geschoven (zie de linker onderstaande afbeelding). Zuivere metalen zijn hierdoor buigbaar. Een mengsel van een metaal en een andere stof noemen we een legering. Doordat verschillende soorten atomen verschillende groottes hebben, verbreekt dit de perfecte orde van het rooster (zie de rechter twee afbeeldingen). Als gevolg hiervan zijn legeringen juist erg sterk.
Een bekend voorbeeld van een legering is staal. Dit bestaat uit ijzer gemengd met een beetje koolstof (zie de onderstaande afbeelding).

 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Moleculaire stoffen
In deze paragraaf bestuderen we een aantal eigenschappen van niet-metalen.
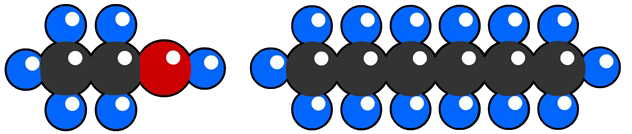
Als we niet-metaalatomen samenbrengen, dan groeperen ze zich meestal in vaste combinaties die we moleculen noemen. In de middelste onderstaande afbeelding zien we bijvoorbeeld twee watermoleculen.
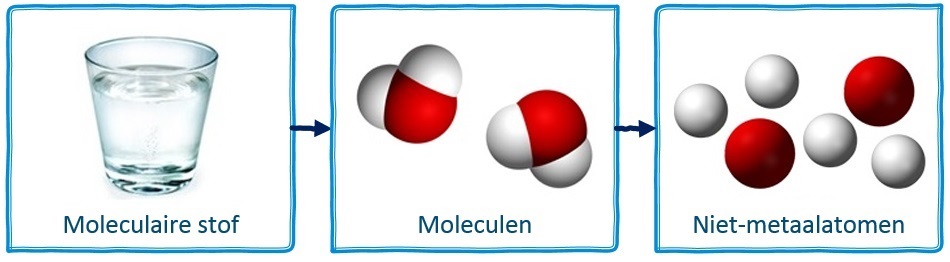
Moleculen beschrijven we met behulp van een molecuulformule. De molecuulformule van een watermolecuul is bijvoorbeeld H2O, omdat het uit twee waterstofatomen (H2) en één zuurstofatoom (O) bestaat.
Ook lucht bestaat uit moleculen. Lucht bestaat voor 78% uit stikstof (N2), voor 21% uit zuurstof (O2) en voor minder dan een procent uit de gassen argon (Ar) en koolstofdioxide (CO2).
Het soort molecuul bepaalt met wat voor soort stof we te maken hebben. Neem bijvoorbeeld de onderste twee moleculen. Een waterstofperoxidemolecuul bevat slechts één zuurstofatoom meer dan water, maar toch is het een geheel andere stof. Waterstofperoxide wordt bijvoorbeeld het gebruikt voor het blonderen van haar!
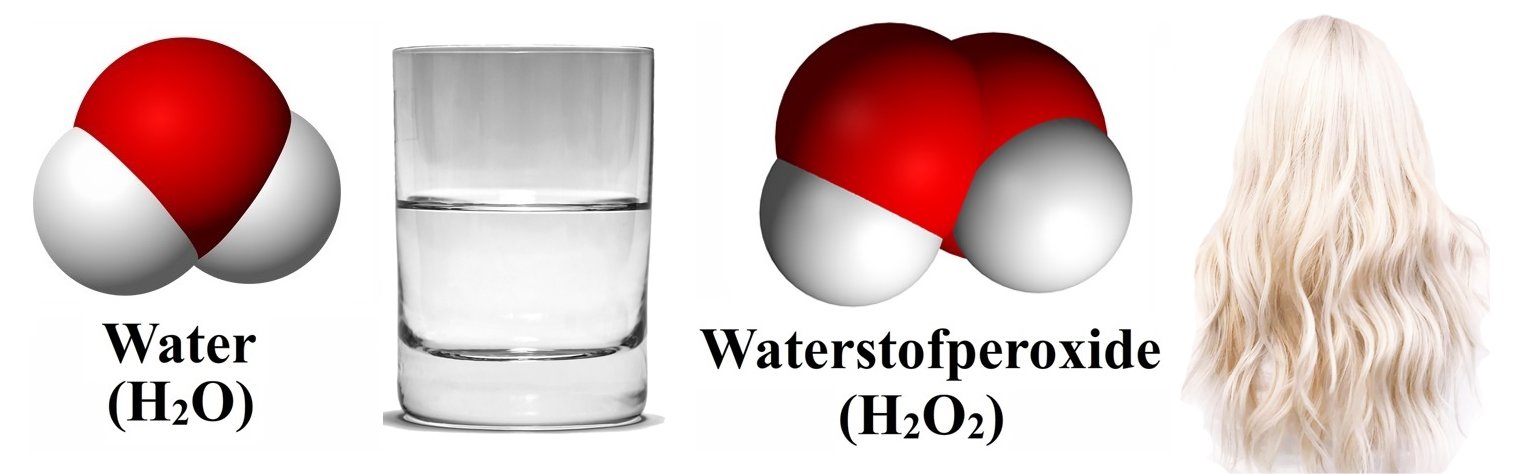
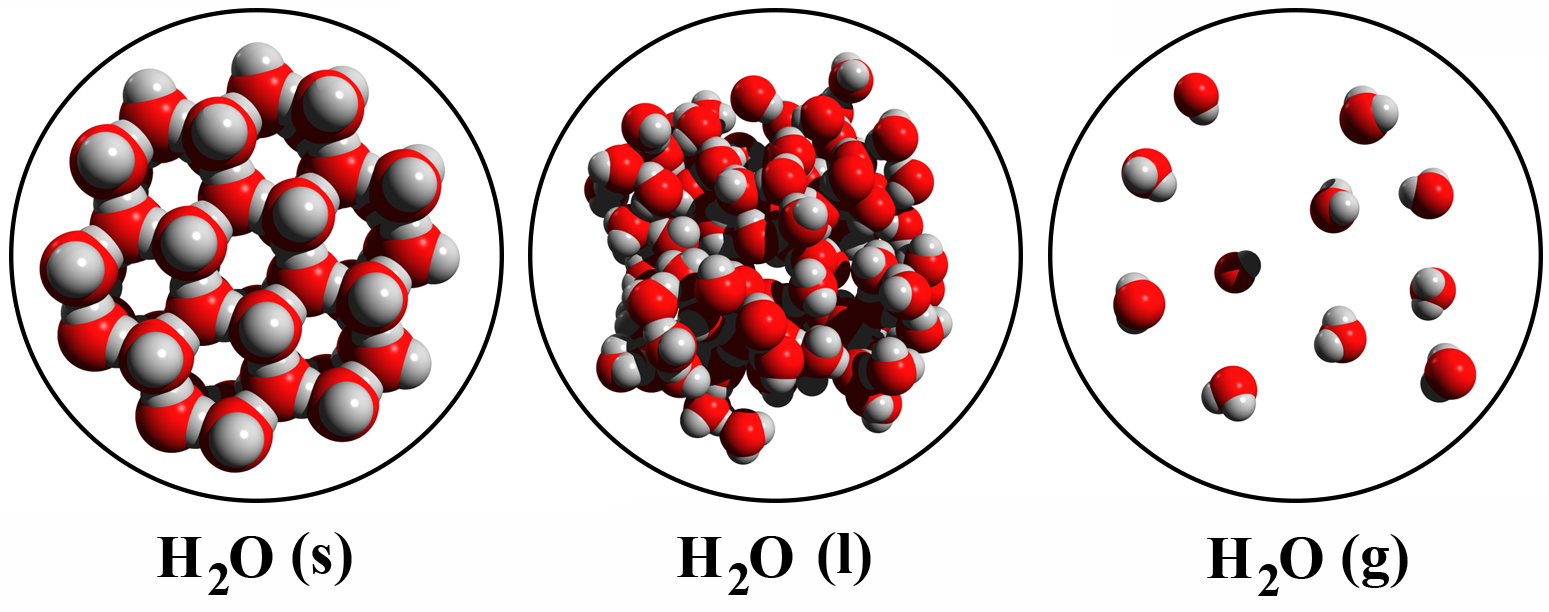
Ook de fase van de stof kunnen we weergeven in de molecuulformule. We gebruiken hiervoor de eerste letters van de Engelse woorden solid (vaste stof), liquid (vloeistof) en gas (gas). We schrijven deze letter tussen haakjes achter de molecuulformule (zie de onderstaande afbeelding).
Ook het aantal moleculen kunnen we in de molecuulformule weergeven. Dit doen we door een getal voor de molecuulformule te schrijven. We noemen dit getal de coëfficiënt. In de onderstaande afbeelding zijn bijvoorbeeld 10 watermoleculen in gasfase afgebeeld. De molecuulformule hiervan wordt dus:
$$ \text{10 H}_2\text{O (g)} $$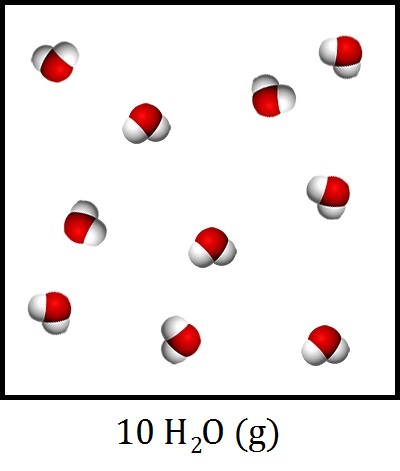
In het onderstaande periodiek systeem zijn de niet-metalen in kleur aangegeven.
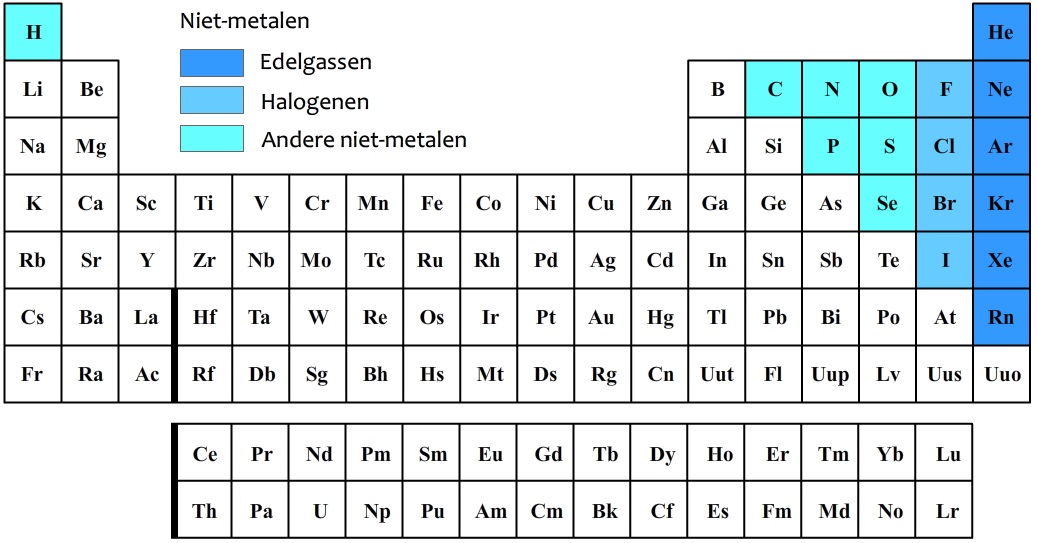
De niet-metalen in de meest rechtse kolom worden de edelgassen genoemd. Edelgassen zijn niet reactief. Dit betekent dat ze vrijwel nooit met andere stoffen reageren. De atomen van edelgassen bewegen allemaal los van elkaar (zie de onderstaande afbeelding). Edelgassen vormen dus geen moleculen.

De niet-metalen in de tweede kolom van rechts worden de halogenen genoemd. De halogenen zijn juist erg reactief en reageren vooral goed met metalen. Moleculen die alleen uit halogeenatomen bestaan, komen voor in paren (dus in groepjes van twee). Dit is goed te zien in de onderstaande afbeelding. Een chloormolecuul heeft dus de molecuulformule Cl2 en bestaat dus uit twee chlooratomen. Een fluormolecuul heeft de molecuulformule F2 en bestaat dus uit twee fluoratomen. Etc.
Naast de halogenen, komen ook stikstofmoleculen (N2), zuurstofmoleculen (O2) en waterstofmoleculen (H2) in paren voor. Het is belangrijk dat je dit onthoudt.

 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Scheiden en ontleden
In deze paragraaf leren we het verschil tussen scheiden en ontleden.
Als we veel energie aan een stof toevoegen, dan kan het gebeuren dat er een chemische reactie optreedt. De stof kan hierbij opsplitsen in twee of meerdere stoffen. We noemen een dergelijke reactie een ontledingsreactie. Stoffen die we kunnen ontleden noemen we ontleedbare stoffen. Stoffen die we niet kunnen ontleden noemen we niet-ontleedbare stoffen.
Suiker kunnen we bijvoorbeeld ontleden in koolstof en water (zie het onderstaande filmpje)(zie het filmpje op de website).
De koolstof die bij het ontleden van suiker ontstaat, kunnen we niet verder ontleden, maar het water wel. Als we water onder stroom zetten, dan ontleedt het in zuurstof en waterstof. Zuurstof en waterstof kunnen we niet verder ontleden (zie de onderstaande afbeelding).
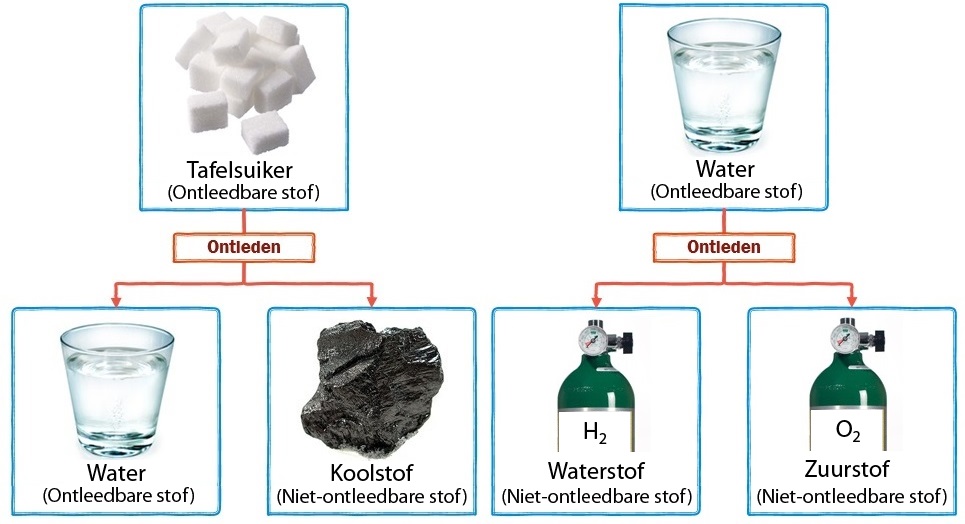
In de onderstaande afbeelding zien we dezelfde reacties op moleculair niveau. Merk op dat de ontleedbare stoffen uit meerdere soorten atomen bestaan. We noemen dit type stoffen ook wel verbindingen. De niet-ontleedbare stoffen bestaan uit slechts één soort atoom. We noemen dit type stoffen ook wel enkelvoudige stoffen of elementaire stoffen. Bij ontleden worden de verschillende soorten atomen dus van elkaar losgetrokken.
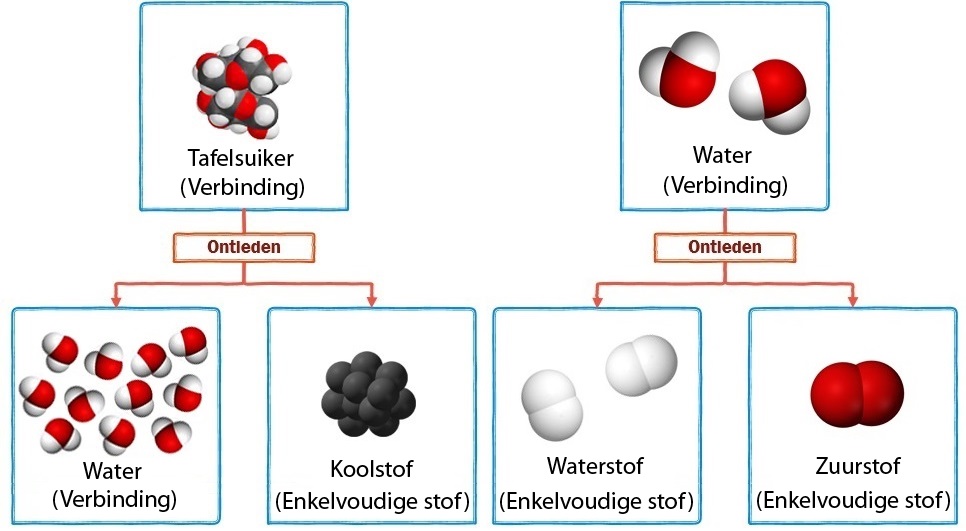
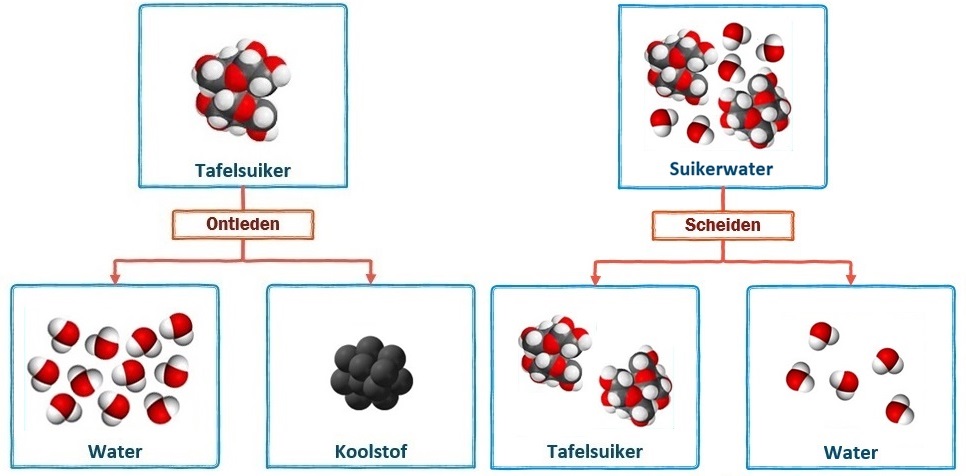
Hieronder zien we links de ontleding van suiker in koolstof en water en rechts het scheiden van suikerwater in water en suiker. Bij ontleden ontstaan nieuwe moleculen en dus nieuwe stoffen. Dit is dus een chemische reactie. Suikerwater daarentegen is een mengsel. Mengsel bestaan uit meerdere soorten moleculen. Tijdens het scheiden ontstaan geen nieuwe moleculen, maar worden de moleculen alleen gesorteerd. Hier heeft dus geen chemische reactie plaatsgevonden.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|