Hoofdstuk 6
Mengen en scheiden
§1 Mengsels §2 Concentratie §3 Stofeigenschappen §4 Bezinken en filtreren §5 Indampen en destilleren §6 Extraheren en adsorptie
§1 Mengsels
In dit hoofdstuk gaan we mengsels bestuderen. In deze paragraaf gaan we het hebben over twee soorten mengsels genaamd oplossingen en suspensies.
Een stof waar we doorheen kunnen kijken noemen we helder. Als we een stof met een vloeistof mengen en het mengsel blijft helder, dan spreken we van een oplossing. Een voorbeeld van een oplossing is zeewater. In zeewater zit zout opgelost, maar toch kunnen we het zout niet zien. Een ander voorbeeld is het oplossen van suiker in thee. Ook hier lijkt het suiker te "verdwijnen" in het water. Oplossingen kunnen wel een kleur hebben. Thee heeft bijvoorbeeld vaak een oranje of bruine kleur.
Hoe komt het dat oplossingen helder zijn? Neem bijvoorbeeld zeewater. Zeewater is helder omdat de zoutdeeltjes zich volledig verspreiden in het water (zie de onderstaande afbeelding). We noemen een dergelijk mengsel een homogeen mengsel. Een zoutdeeltje is een miljoen keer kleiner dan een millimeter en kan dus niet met onze ogen gezien worden. Omdat alle deeltjes los van elkaar door het water bewegen, kunnen we ze dus niet zien.

Ook gassen vormen homogene mengsels. Neem bijvoorbeeld de lucht. De lucht bestaat o.a. uit de gassen stikstof, zuurstof en een beetje koolstofdioxide. Omdat de deeltjes in een gas los van elkaar bewegen, kunnen gassen altijd goed mengen en vormen ze dus altijd homogene mengsels. Elk mengsel van gassen is daarom altijd helder (maar net als bij vloeistoffen kunnen gassen wel een kleur hebben).
Een vloeistof waar we niet doorheen kunnen kijken noemen we troebel. Als we een stof met een vloeistof mengen en het mengsel wordt troebel, dan spreken we van een suspensie. Er ontstaat bijvoorbeeld een suspensie als we krijtstof mengen met water. Een suspensie ontstaat doordat het krijt zich niet perfect mengt met het water. De krijtdeeltjes blijven in kleine klontjes aan elkaar plakken en deze klontjes zweven rond in het water (zie de onderstaande afbeelding). Omdat deze klontjes groot genoeg zijn om met onze ogen te kunnen zien, kunnen we niet door een suspensie heen kijken. We noemen een dergelijk mengsel een heterogeen mengsel.

Naast suspensies bestaan er ook nog andere heterogene mengsels. Een voorbeeld is rook. Rook is een collectie van kleine stukjes vaste stof die in de lucht zweven. Rook is dus geen gas, maar bestaat uit kleine stukjes vaste stof (zie de twee onderstaande afbeeldingen).

 (Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
(Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
Een ander voorbeeld van een heterogeen mengsel is een nevel. Nevel is een collectie van kleine vloeibare druppeltjes die in de lucht zweven. We kunnen bijvoorbeeld een nevel maken door een fles haarlak of deodorant te spuiten. Ook wolken en mist zijn nevels.


 (Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
(Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
Een ander voorbeeld van een heterogeen mengsel is schuim. Een schuim bestaat uit gasbelletjes die zich in een vloeistof of een vaste stof bevinden. Denk bijvoorbeeld aan de "prik" in cola. Dit bestaat uit kleine belletjes koolstofdioxide. Een ander voorbeeld is piepschuim. Dit bestaat uit plastic bolletjes gevuld met lucht.

 (Afbeelding: Pixabay; PD)
(Afbeelding: Pixabay; PD)
Het laatste voorbeeld van een heterogeen mengsel is een emulsie. Een emulsie bestaat uit stoffen die onder normale omstandigheden niet mengen, maar die door een extra stof, genaamd de emulgator, toch mengen. Voorbeelden van emulsies zijn mayonaise en crèmes. Mayonaise bestaat voornamelijk uit olie en een beetje azijn. Zoals je in de linker onderstaande afbeelding kan zien, mengen deze vloeistoffen onder normale omstandigheden niet. Als emulgator voegen we eigeel toe en zo ontstaat de emulsie mayonaise. Een crème is een emulsie bestaande uit o.a. water, een vet of een olie en een emulgator. Crèmes worden op de huid gesmeerd om de huid te verzorgen of als medicatie tegen bijvoorbeeld huidaandoeningen.

 (Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
(Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||||||||
|
§2 Concentratie
In deze paragraaf gaan we leren rekenen met concentratie. Een bekend voorbeeld waarbij concentratie een rol speelt is limonade. Hoe meer siroop er in een bepaalde hoeveelheid water wordt gedaan, hoe hoger de concentratie.
Als we twee stoffen met elkaar mengen, dan kunnen we dit in verschillende verhoudingen doen. Denk bijvoorbeeld aan limonade. We kunnen zelf kiezen hoeveel siroop en hoeveel water we toevoegen bij het maken van limonade. De hoeveelheid water en de hoeveelheid siroop bepalen samen hoe zoet de limonade zal smaken. Als de limonade erg zoet is, dan spreken we van een hoge concentratie siroop. Als je de siroop bijna niet proeft, dan spreken we van een lage concentratie siroop.
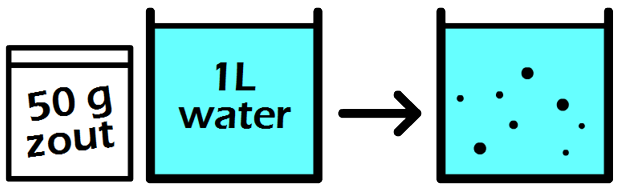
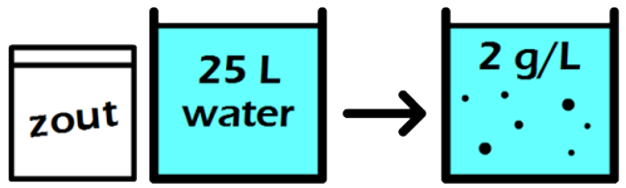
In de onderstaande afbeelding zien we een maatkolf. Stel we schenken 24 gram siroop in de maatkolf en vullen dit daarna aan met water tot aan de stippellijn. Zoals aangegeven op de maatkolf, hebben we dan 1000 mL (1 L) limonade. De limonade die we nu gemaakt hebben, heeft een siroopconcentratie van 24 gram per liter (24 g/L).

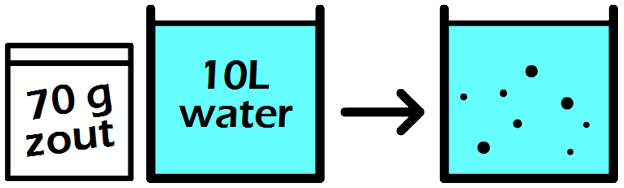
In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 2000 mL (2 liter) limonade hebben. Elke liter limonade bevat in dit geval dus 24 / 2 = 12 gram siroop. De siroopconcentratie is in dit geval dus 12 g/L. In dit tweede voorbeeld is de siroopconcentratie dus lager en als gevolg smaakt de limonade minder zoet.

In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 250 mL (0,25 liter) limonade hebben. In dit geval zou een liter van deze limonade 24 × 4 = 96 gram siroop bevatten. Deze limonade heeft dus een siroopconcentratie van 96 g/L. In dit voorbeeld is de concentratie dus hoger en smaakt de limonade dus zoeter.

 Voorbeeld
Voorbeeld
| ||||||||||||||||||
|
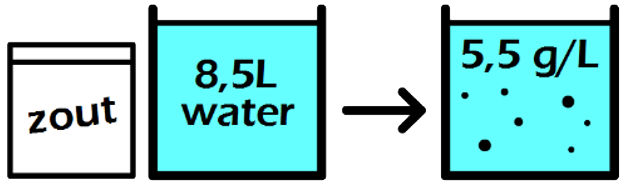
Vraag: Een leerling maakt eerst 1,2 L limonade met daarin 10 gram siroop en daarna ook nog 0,15 L limonade met daarin 2,0 gram siroop. Welke limonade smaakt zoeter? Antwoord: We kunnen deze vraag beantwoorden door de gegevens te noteren in een verhoudingstabel. De eerste soort limonade bevat 10 gram siroop en heeft een volume van 1,2 liter. Als we de concentratie van deze limonade willen weten, dan willen we weten hoeveel gram siroop er in 1 liter van deze limonade opgelost is:
De gemakkelijkste manier om met verhoudingstabellen te rekenen is door kruislings te vermenigvuldigen. Je vermendigvuldigt in dat geval de twee getallen die diagonaal genoteerd zijn en daarna deel je door het overgebleven getal. In de instructiefilmpjes bij deze paragraaf wordt deze techniek uitgebreid uitgelegd. We vinden hiermee: $$ (10 \times 1)/1,2 = 8,3 \text{ g} $$Dit antwoord vullen we in de verhoudingstabel in:
Deze limonade heeft dus een concentratie van 8,3 g/L. Op dezelfde manier vinden we de concentratie van de tweede limonade. Hier hadden we 2,0 gram siroop in 0,15 liter limonade. De concentratie wordt hiermee:
Deze limonade heeft dus een concentratie van 13 g/L. Met deze gegevens zijn we in staat de vraag te beantwoorden. Omdat de tweede limonade een hogere concentratie heeft, smaakt deze limonade het zoetst.
|
 Voorbeeld
Voorbeeld
| ||||||
|
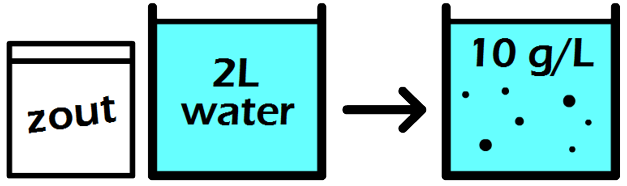
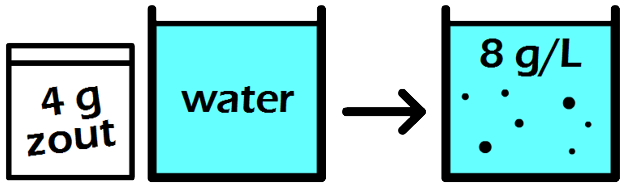
Vraag: Een leerling maakt 2,5 L limonade met een concentratie van 34 g/L. Hoeveel gram siroop is er gebruikt om deze limonade te maken? Antwoord: Een siroopconcentratie van 34 g/L betekent dat er 34 gram siroop gebruikt is voor één liter van deze limonade. Door kruislings te vermenigvuldigen vinden we dan voor 2,5 liter limonade:
Er is dus 85 gram siroop gebruikt voor de 2,5 L limonade.
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Stofeigenschappen
In de rest van dit hoofdstuk bespreken we een aantal methodes om mengsels te scheiden. Dit kunnen we doen door gebruik te maken van de verschillende stofeigenschappen van stoffen. Wat stofeigenschappen zijn bespreken we in deze paragraaf.
Sommige eigenschappen van stoffen kunnen gebruikt worden om de stoffen te herkennen. We noemen dit stofeigenschappen. Een stuk goud heeft bijvoorbeeld altijd deze eigenschappen:
- Gele kleur
- Glanzend
- Vast bij kamertemperatuur
- Vervormbaar
- Goede geleider van elektriciteit
- Niet brandbaar
- Smeltpunt van 1064 graden Celsius
- Kookpunt van 2856 graden Celsius
- Dichtheid van 19,3 g/cm3
Als we een stof vinden met al deze eigenschappen, dan weten we dat dit goud is. Als het één van deze eigenschappen niet heeft, dan weten we zeker dat het geen goud is.
Niet alle eigenschappen van een stof zijn ook meteen stofeigenschappen. Als je een stuk goud hebt met een massa van 500 gram dan wil dat niet zeggen dat elk stuk goud een massa van 500 gram heeft. Massa is dus geen stofeigenschap. De dichtheid van goud is wel een stofeigenschap, want de dichtheid van elk stuk goud is 19,3 g/cm3.
Ook de fase van een stof is geen stofeigenschap. Goud kan voorkomen als vaste stof, maar ook als vloeistof of gas en daarom is de fase geen stofeigenschap. De fase bij kamertemperatuur is wel een stofeigenschap. Goud is bij kamertemperatuur immers altijd een vaste stof.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Bezinken en filtreren
In deze paragraaf beginnen we met het bespreken van scheidingsmethoden. Dit zijn methoden waarmee we de stoffen in een mengsel kunnen scheiden. We beginnen met bezinken en filtreren.
Het is gemakkelijk om van twee zuivere stoffen een mengsel te maken, maar het omgekeerde is vaak lastiger. Stel je mengt suiker en meel. In dat geval komen vele duizenden suikerkorrels en meelkorrels door elkaar te liggen. Het lijkt misschien een onmogelijke taak om deze stoffen weer te scheiden, maar toch bestaan er een aantal technieken om dit te doen. We noemen dit scheidingsmethoden.
Scheidingsmethoden maken gebruik van verschillende stofeigenschappen van de gemengde stoffen. In de rest van het hoofdstuk gaan we hier voorbeelden van zien.
De simpelste scheidingsmethode wordt bezinken genoemd. Stel we hebben een mengsel van zand en water. Om dit mengsel voor een deel te scheiden hebben we alleen een beetje geduld nodig. Omdat zand een grotere dichtheid heeft dan water, zakt het na verloop van tijd vanzelf naar de bodem (zie de onderstaande linker afbeelding). De stof die op de bodem komt te liggen—in dit geval het zand—noemen we het bezinksel. Het water kan je daarna voorzichtig afgieten (zie de rechter afbeelding). Deze scheidingsmethode maakt dus gebruik van het verschil in de stofeigenschap dichtheid.

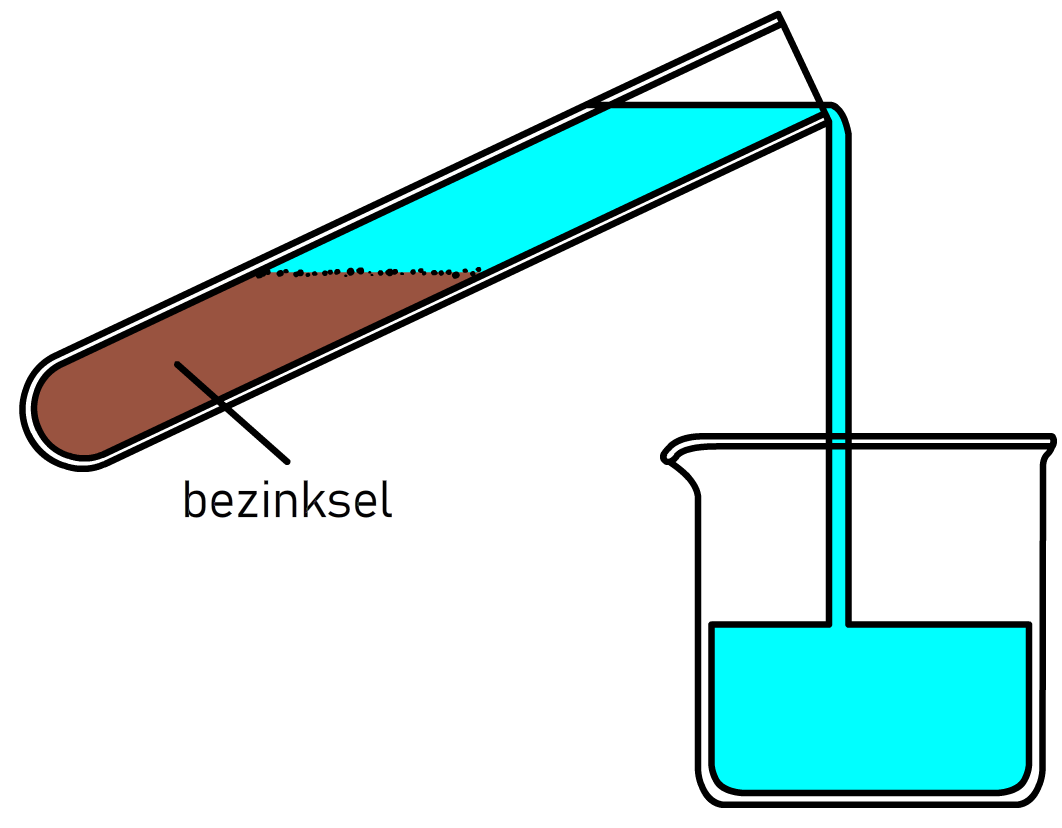 (Afbeelding: Tummers77; CC BY-SA 4.0)
(Afbeelding: Tummers77; CC BY-SA 4.0)
Een andere bekende scheidingsmethode wordt filtreren genoemd. Hiermee kunnen we suspensies scheiden. Een filter is een stukje papier met daarin microscopische gaatjes waar losse deeltjes gemakkelijk doorheen gaan, maar waar de klontjes in een suspensie in blijven steken. In de onderstaande afbeelding zien we een gele suspensie die in een filter wordt geschonken. De gele korrels blijven in het filter hangen, terwijl de waterdeeltjes gemakkelijk door het filter stromen en in het bekerglas terecht komen. De stof die achterblijft in het filter noemen we het residu (in dit geval de gele korrels). De stof die door het filter stroomt noemen we het filtraat (in dit geval het water). Bij deze scheidingsmethode wordt dus gebruik gemaakt van de stofeigenschap deeltjesgrootte om de stoffen te kunnen scheiden.

Een mondkapje is ook een voorbeeld van een filter. Lucht gaat moeiteloos door dit filter heen, omdat dit gas uit losse deeltjes bestaat. Rookdeeltjes blijven bijvoorbeeld in het filter hangen, omdat deze stoffen uit grotere klontjes vaste stof bestaan. Op deze manier kunnen we ademen zonder deze rookdeeltjes binnen te krijgen. Het nadeel van een mondkapje is dat schadelijke gassen wel gewoon door het filter heen gaan. Hiertegen beschermt een mondkapje dus niet.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Indampen en destilleren
In deze paragraaf gaan we nog twee scheidingsmethoden bestuderen genaamd indampen en destilleren.
In de vorige paragraaf hebben we geleerd dat we suspensies kunnen scheiden met een filter. In het geval van een oplossing gaat dit echter niet lukken. Een oplossing bestaat immers uit allemaal losse deeltjes en die gaan dus allemaal door het filter. We hebben in dat geval dus een andere scheidingsmethode nodig.
De simpelste manier om een oplossing te scheiden wordt indampen genoemd. Indampen is het verhitten van een oplossing, zodat één stof in de oplossing verdampt, terwijl de andere achterblijft (zie de onderstaande afbeelding). Neem bijvoorbeeld zeewater. Als we zeewater aan de kook brengen, dan zal het water verdampen, maar het zout niet. Zout heeft namelijk een kookpunt van wel 1413 °C, terwijl het kookpunt van zeewater net iets boven de 100 °C ligt. Bij deze techniek maken we dus gebruik van het verschil in de stofeigenschap kookpunt om verschillende stoffen te scheiden.

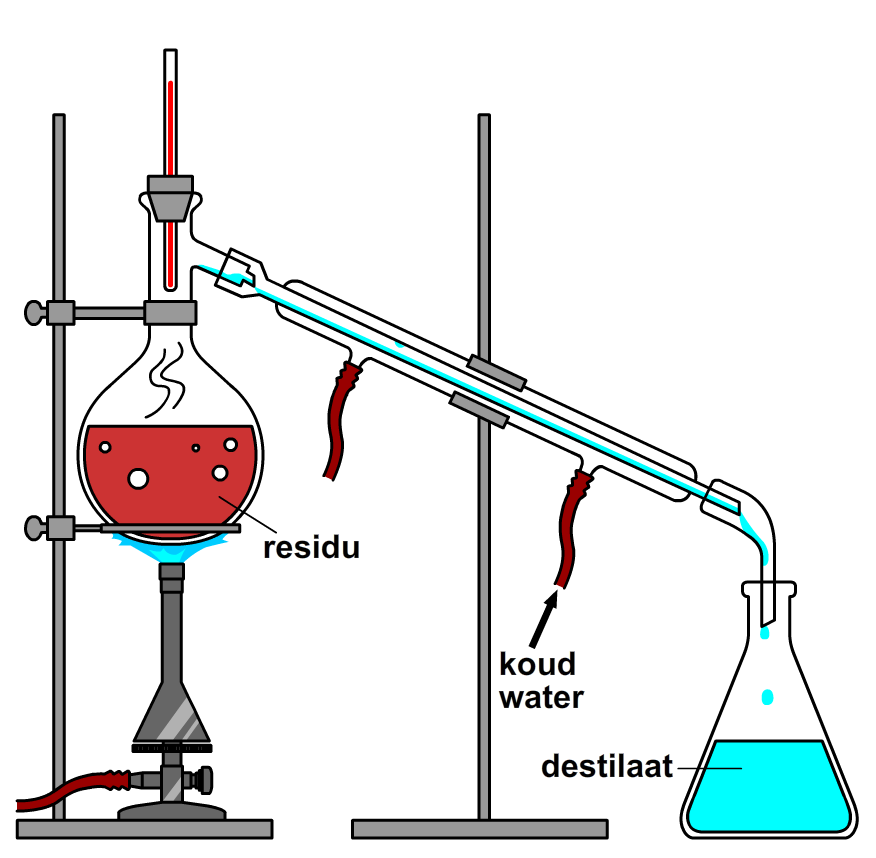
Bij indampen van zeewater hou je zout over, maar wat als je nu juist het water wilt hebben, bijvoorbeeld om drinkwater van zeewater te maken? In dat geval gebruiken we een scheidingsmethode die destillatie wordt genoemd. Bij destillatie vangen we de verdampte stof op in een afgekoelde buis. De lage temperatuur van deze buis zorgt ervoor dat de verdampte stof gemakkelijk condenseert. De druppels die hierbij ontstaan, glijden door de buis naar beneden en worden opgevangen in een erlenmeyer (zie de onderstaande afbeelding). De stof die achterblijft noemen we wederom het residu. De stof die opgevangen wordt noemen we het destillaat.
 EXPERIMENT
EXPERIMENT
| ||
|
Destillatie kan bijvoorbeeld gebruikt worden om (bijna) zuivere alcohol uit wijn te halen. Wijn bestaat voor het grootste gedeelte uit water en alcohol. Water heeft een kookpunt van 100 °C en alcohol van 78 °C. Als we de wijn verhitten tussen deze twee kookpunten in, dan verdampt de alcohol wel, maar het water niet. Op deze manier kan je bijna pure alcohol verkrijgen. Pure alcohol is een brandstof en kan met een lucifer in brand worden gestoken (zie de onderstaande afbeelding).
 (Afbeelding: SirVir; CC BY-SA 3.0)
(Afbeelding: SirVir; CC BY-SA 3.0)
Ook als we kraanwater indampen of destilleren blijft er een residu achter. We noemen dit kalk (zie de onderstaande afbeelding). Ditzelfde proces zorgt bijvoorbeeld voor kalkaanslag in de badkamer. Het water dat we opvangen bij de destillatie van water noemen we gedestilleerd water. Dit is (bijna) zuiver water.

 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§6 Extractie en adsorptie
In deze paragraaf gaan we nog twee scheidingsmethoden bestuderen, genaamd extractie en adsorptie.
Een andere scheidingsmethode wordt extraheren of extractie genoemd. Extraheren werkt als één van de stoffen in een mengsel oplosbaar is en de andere niet. Hier scheiden we dus op basis van de stofeigenschap oplosbaarheid. In zoutmijnen zit zout bijvoorbeeld vaak vast in poreuze stenen. Als we het zout uit de stenen willen verwijderen, dan voegen we eerst warm water toe. Het zout lost op in dit water, maar het steen natuurlijk niet. Het opgeloste zout kan dan opgepompt worden. Door middel van indampen kan het zout dan gewonnen worden.
We zijn ook aan het extraheren als we een theezakje in heet water dopen. Een aantal stoffen uit de theeblaadjes lost op in het water, terwijl de blaadjes zelf niet oplossen (zie de onderstaande linker afbeelding). Merk op dat het theezakje ook dient als een filter, waar de theeblaadjes niet doorheen kunnen. In de rechter afbeelding zien we een theezakje in koud water en een theezakje in warm water. Zoals je kan zien werkt extraheren beter bij hogere temperatuur. Dit komt omdat deeltjes bij hogere temperatuur sneller bewegen en hierdoor lossen stoffen sneller op.

 (Afbeelding: Pixabay; PD)
(Afbeelding: Pixabay; PD)
Een andere scheidingsmethode wordt adsorptie genoemd (niet te verwarren met 'absorptie'). Adsorptie is het proces waarbij moleculen zich hechten aan een andere stof. Hoe goed stoffen hechten aan andere stoffen is ook een stofeigenschap. Het bekendste adsorptiemiddel is actieve kool. Dit is een zwart poeder waarin vele microscopische poriën zitten (zie de onderstaande afbeelding).

 (Afbeelding: Ravedave; CC BY 2.5 / SomnathWiki007; CC BY 4.0)
(Afbeelding: Ravedave; CC BY 2.5 / SomnathWiki007; CC BY 4.0)
Sommige stoffen blijven in deze poriën vastzitten. Actieve kool wordt bijvoorbeeld gebruikt om kleurstoffen te verwijderen uit vloeistoffen. Als we van slootwater drinkwater willen maken, dan kunnen we actieve kool bijvoorbeeld gebruiken om de gelige kleur van het slootwater te verwijderen (zie de onderstaande linker afbeeldingen). Ook wordt actieve kool gebruikt in gasmaskers om gevaarlijke gassen uit de lucht te filteren (zie de rechter afbeelding).


 EXPERIMENT
EXPERIMENT
|
| In de onderstaande video's zien we dat actieve kool de blauwe kleurstof methyleenblauw verwijdert uit een vloeistof en NO2 verwijdert uit de lucht. |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|