In deze paragraaf bestuderen we een aantal eigenschappen van metalen.
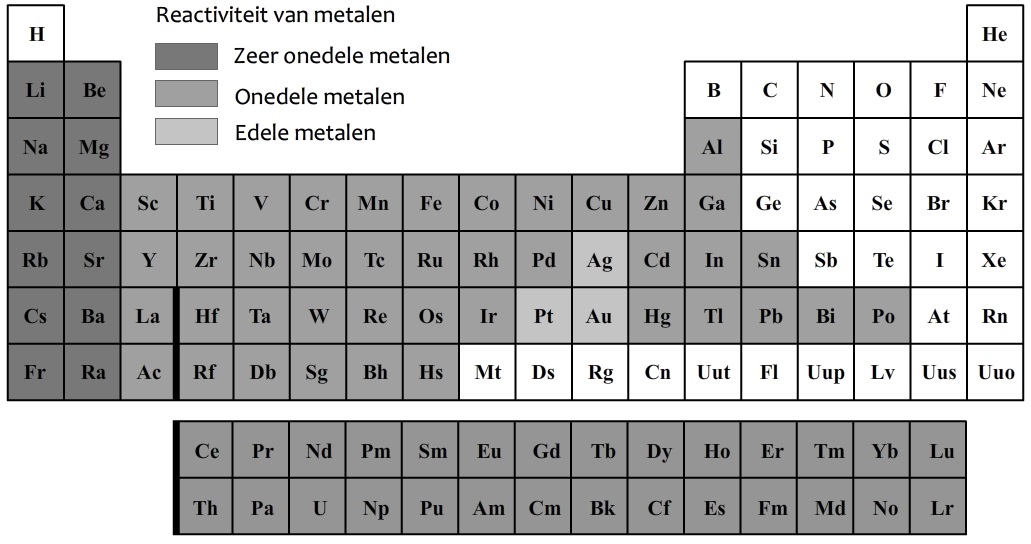
In de onderstaande afbeelding zijn de metalen in het periodiek systeem in het grijs aangegeven. De metalen in de eerste twee kolommen van het periodiek systeem worden de zeer onedele metalen genoemd. Deze metalen zijn extreem reactief. De stoffen in de eerste kolom reageren bijvoorbeeld heftig met water en zuurstof. De stoffen in de tweede kolom reageren heftig met zuurstof.
De stoffen zilver (Ag), goud (Au) en platinum (Pt) worden de edele metalen genoemd. Deze metalen reageren niet of nauwelijks met andere stoffen. De overige metalen noemen we de onedele metalen. Deze metalen zijn wel reactief, maar deze reacties verlopen meestal langzaam.
Het reageren van een metaal met zuurstof noemen we oxideren. Het bekendste voorbeeld hiervan hebben we al gezien in een eerdere paragraaf: de oxidatie van ijzer, waarbij een oranje stof genaamd roest ontstaat. We noemen het oxideren van ijzer daarom ook wel roesten. Een ander bekend voorbeeld is het oxideren van koper. Geoxideerd koper is lichtgroen. Het Vrijheidsbeeld is hier bijvoorbeeld van gemaakt.
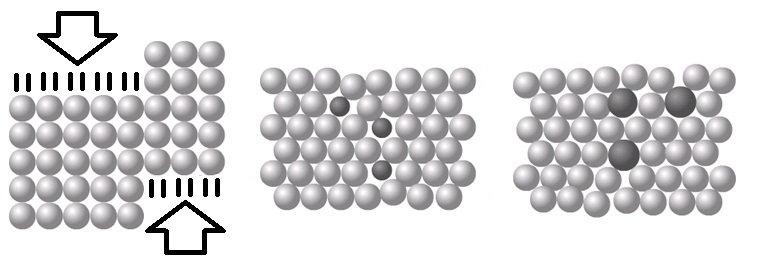
Als we metaalatomen samenbrengen, dan ordenen ze zich meestal in een regelmatig patroon dat een metaalrooster wordt genoemd (zie de onderstaande afbeelding).

Een zuiver metaal bestaat slechts uit één soort atoom en de metaalroosters zijn daardoor erg geordend. Het gevolg hiervan is dat de atomen in deze roosters gemakkelijk langs elkaar kunnen worden geschoven (zie de linker onderstaande afbeelding). Zuivere metalen zijn hierdoor buigbaar Een mengsel van een metaal en een andere stof noemen we een legering. Doordat verschillende soorten atomen verschillende groottes hebben, verbreekt dit de perfecte orde van het rooster (zie de rechter twee afbeeldingen). Als gevolg hiervan zijn legeringen juist erg sterk.
Een bekend voorbeeld van een legering is staal. Dit bestaat ijzer gemengd met een beetje koolstof (zie de onderstaande afbeelding).

- Maak een tekening van aluminium op atomaire niveau.
- Noem drie zeer onedele, drie onedele en drie edele metalen.
- Goud komt in de natuur in zuivere vorm voor. IJzer echter niet. Leg uit hoe dit komt.
- Chroom is een duur metaal. Toch worden metalen voorwerpen in de badkamer omhult door een laagje chroom. Bedenk waarom dit gedaan wordt.
- Trouwringen bestaan meestal voor een groot deel uit goud. Zuiver goud is echter niet geschikt voor sieraden. Bedenk waarom dit zo is.
-
Brons is een legering van 90% koper en 10% tin.
Een tin-atoom is iets groter dan een koperatoom.
- Teken een model van brons met 20 atomen.
- Leg aan de hand van deze tekening uit waardoor brons stugger is dan koper.
 Redeneren over edele en onedele metalen en tekenen van metaalroosters
Redeneren over edele en onedele metalen en tekenen van metaalroosters